Пчя в медицине что такое
Пчя в медицине что такое
Основание черепа (дно полости черепа) является сложной анатомической областью, представляя собой границу между головным мозгом, структурами лица и верхней части шеи. Понимание анатомии основания черепа необходимо для точной диагностики и эффективного лечения заболеваний данной области. И оториноларингологи, и нейрохирурги планируют будущее оперативное вмешательство, основываясь на взаимоотношениях опухоли или патологического процесса с близлежащими внутричерепными или нервно-сосудистыми анатомическими образованиями.
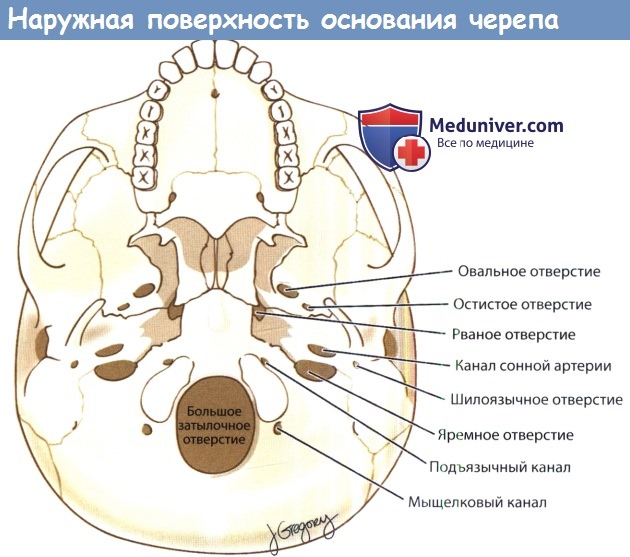
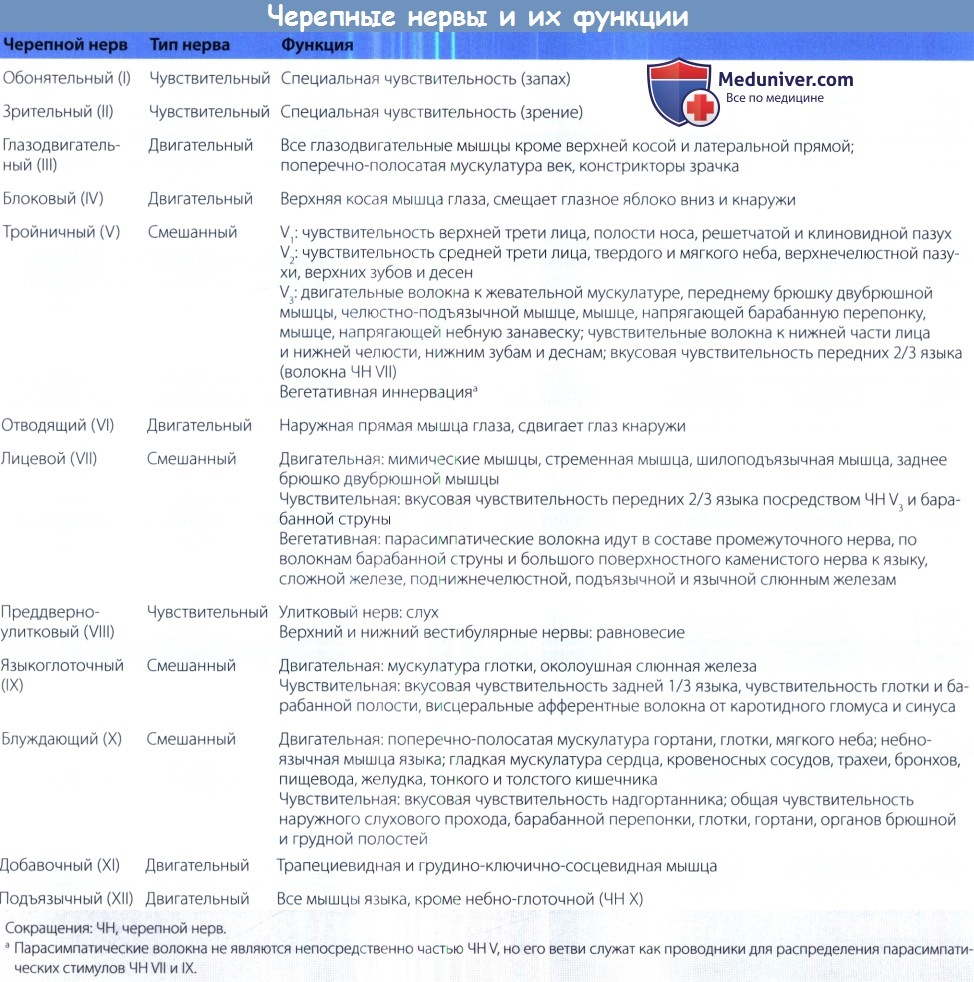
Основание черепа состоит из пяти костей: лобной, решетчатой, височной, клиновидной и затылочной; из них парными являются лобная и височная кости. В каждой кости имеются отверстия, через которые проходят черепные нервы (ЧН I—XII), артерии и нервы (описаны подробнее далее). Для успешной диагностики и лечения заболеваний основания черепа врач должен хорошо знать расположение, содержимое и взаимоотношение друг с другом этих отверстий. Также эти знания помогают в понимании путей распространения инфекционного процесса, как экстракраниального, так и интракраниального.
Определенные костные ориентиры подразделяют основание черепа на три отдельных области: переднюю, среднюю и заднюю черепные ямки. Передняя и средняя черепные ямки отделены друг от друга малыми крыльями клиновидной кости и клиновидной площадкой; а спинка турецкого седла, наклоненные задние отростки, края пирамид височных костей отделяют среднюю ямку от задней. Основание черепа имеет наибольший размер в переднезаднем направлении; наименьшей толщины оно достигает в краниокаудальном направлении, за исключением пирамиды височной кости, его толщина не превышает 3-5 мм.
В этой и дальнейших статьях на сайте будут описаны анатомические границы передней, средней и задней черепных ямок, их содержимое и важные взаимоотношения с внечерепными структурами. Будут выделены моменты, имеющие наибольшую клиническую значимость. Также в отдельной статье мы обсудим границы, содержимое и взаимоотношения подвисочной ямки.
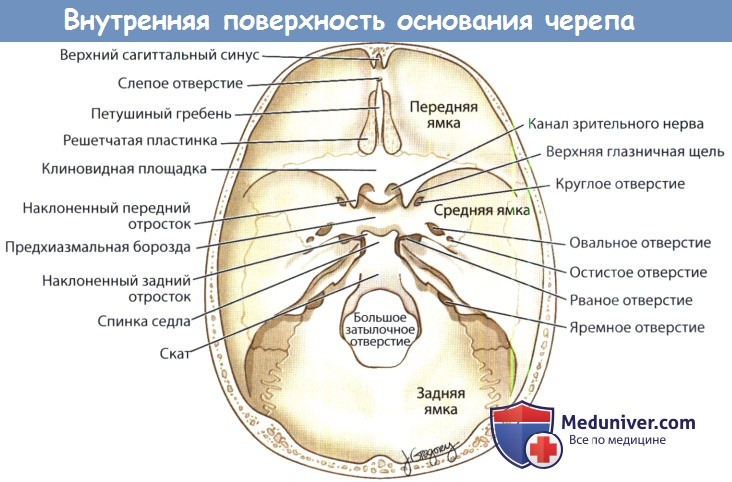
а) Границы и отверстия передней черепной ямки (переднего отдела основания черепа). Передняя черепная ямка спереди ограничена глазничными частями лобных костей, сзади — малыми крыльями и телом клиновидной кости, по центру — решетчатой пластинкой решетчатой кости. Латеральные границы передней черепной ямки представлены лобными костями, в которых имеются надглазничные отверстия. Самой глубокой и тонкой частью передней черепной ямки является ситовидная пластинка. В ситовидной пластинке имеется 15-20 мелких отверстий, через которые обонятельные нервы (ЧНI) проходят от обонятельных луковиц, расположенных интракраниально, к верхним отделам слизистой оболочки полости носа.
В переднемедиальной области ситовидной пластинки находится петушиный гребень, crista galli, к этому костному образованию, отходящему вверх и разделяющему два полушария головного мозга, крепится серп мозга, falx cerebri.
Спереди от петушиного гребя расположено слепое отверстие, foramen caecum, непостоянное углубление в лобно-решетчатом шве, через которое эмиссарные вены полости носа могут сообщаться с расположенным в полости черепа верхним сагиттальным синусом. Непосредственно сбоку от решетчатой пластинки расположены решетчатые ямки, fovea ethmoidalis, которые представляют собой крышу решетчатого лабиринта. Обычно толщина костной стенки решетчатых ямок больше, чем толщина соседней решетчатой пластинки, а сами ямки расположены выше. Тем не менее, встречаются и индивидуальные отклонения от такой анатомической картины. Знание этих взаимоотношений, а также способность оценить их у конкретного пациента, являются обязательными при выполнении эндоназальных операций и при удалении опухолей переднего основания черепа.
В переднелатеральном и заднелатеральном отделах соответственно проходят передняя и задняя решетчатые артерии, ветви глазной артерии. Здесь они покидают полость черепа и входят в полость носа. Сзади решетчатая пластинка соединяется с центральной частью (телом) клиновидной кости, образуя клиновидную площадку, planum sphenoidale. По центру расположен зрительный перекрест, а латеральнее и кзади малые крылья клиновидной кости образуют передние наклоненные отростки и крышу каналов зрительных нервов.
б) Содержимое переднего отдела основания черепа. В передней черепной ямке находятся лобные доли головного мозга, обонятельные луковицы и тракты, нижний и верхний сагиттальные синусы. Обонятельный нерв (ЧН I) — это первый афферентный чувствительный нерв, состоящий из биполярных нейронов с короткими периферическими и длинными центральными отростками. Периферические рецепторные клетки обонятельного анализатора расположены на уровне верхних 2 см 2 каждой половины носа, вблизи решетчатых пластинок, верхних отделов перегородки, верхних отделов латеральной стенки полости носа.
Сотни центральных отростков пересекают решетчатую пластинку в виде демиелинизированных обонятельных волокон, fila olfactoria; с каждой стороны от петушиного гребня имеется примерно по 20 обонятельных волокон. Эти волокна объединяются в области ипсилатеральной обонятельной луковицы, и представляют собой части головного мозга, расположенные на вентральной поверхности лобных долей вблизи решетчатой пластинки. Повреждение этой области при травме, плановой операции на переднем основании черепа или эндоскопическом вмешательстве на околоносовых пазухах может вызвать развитие ликвореи, аносмии или гипосмии (невозможность восприятия запахов или снижение остроты обоняния, соответственно).
После образования синапсов в обонятельных луковицах вторичные чувствительные нейроны образуют обонятельный тракт, в составе которого следуют назад вдоль вентральной поверхности лобной доли. Вены передней черепной ямки являются одним из способов внутричерепного распространения инфекции.
Отроги твердой мозговой оболочки к лобному гребню и петушиному гребню формируют серп мозга, через который проходят верхний и нижний сагиттальные синусы. Эти венозные сосуды лишены клапанов, в них оттекает кровь от головного мозга, мозговых оболочек и диплоических пространств костей черепа. В дальнейшем они формируют внутреннюю яремную вену. Инфекция из лобной пазухи может распространиться в передний отдел основания черепа по бесклапанным венам Брехета, диплоическим венам задней стенки лобной кости. Зияние слепого отверстия, которое располагается кпереди от петушиного гребня, является анатомической предпосылкой к формированию определенных аномалий развития полости носа (глиомы, энцефалоцеле, менингоэнцефалоцеле).
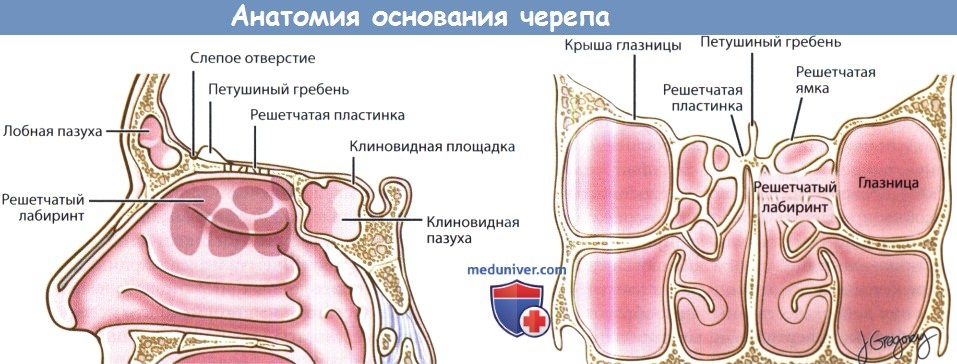
Обратите внимание на то, что решетчатая пластинка и решетчатые ямки являются разными анатомическими образованиями.
в) Взаимоотношения переднего основания черепа (передней черепной ямки) с внечерепными структурами. Наиболее важными являются взаимоотношения передней черепной ямки с глазницами и околоносовыми пазухами. Как уже говорилось выше, дно передней черепной ямки одновременно является крышей орбит, решетчатого лабиринта, клиновидной пазухи, а также выступает в качестве задней стенки лобной пазухи. Опухолевые образования данной локализации, например, эстезионейробластома (редкая опухоль, происходящая из обонятельного нейроэпителия), могут распространяться в переднюю черепную ямку снизу, а первичные интракраниальные опухоли могут расти в противоположном направлении. Эти анатомические взаимоотношения необходимо учитывать при планировании хирургических вмешательств и при разработке доступа к переднему отделу полости черепа.
Близость костных стенок глазниц к передней черепной ямке и подвисочной ямке объясняет существование различных путей распространения внутри- и внечерепных патологических процессов; в первую очередь заболевание может распространяться посредством верхней и нижней глазничных щелей, а также через канал зрительного нерва. Через верхнюю глазничную щель проходят глазодвигательный нерв (ЧН III), блоковый нерв (ЧН IV), отводящий нерв (ЧН VI), глазничная ветвь тройничного нерва (ЧН V1), а также глазные вены. Формально эти образования располагаются в средней черепной ямке. Через нижнюю глазничную (подглазничную) щель проходит верхнечелюстная ветвь тройничного нерва (ЧН V ) и подглазничные сосуды; в отличие от верхней глазничной щели она напрямую сообщается с подвисочной и крыловидно-небной ямками. Через канал зрительного нерва проходит зрительный нерв (ЧН II) и глазничная артерия.
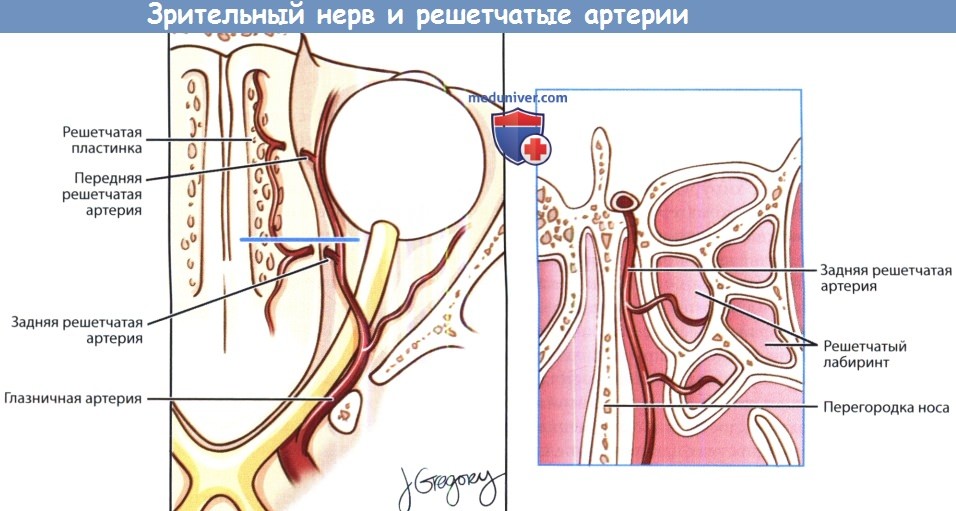
с решетчатым лабиринтом и клиновидной пазухой.
Видео урок анатомия передней черепной ямки
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Обзор онкологических заболеваний менингиомы
Вам поставили диагноз: менингиома?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать».
Предлагаем Вашему вниманию краткий, но подробный обзор одной из разновидности опухолей головного мозга.
Ежегодно в России выявляют более 8 тысяч новых заболеваний опухолей мозговой оболочки, головного и спинного мозга и других частей центральной нервной системы. Почти такое же количество граждан умирает от данных локализаций.
Филиалы и отделения, где лечат менингиомы
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отделение нейроонкологии
Заведующий – к.м.н. ЗАЙЦЕВ Антон Михайлович
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отделение протонной и фотонной терапии
Заведующий – д.м.н. ГУЛИДОВ Игорь Александрович
Тел: 8 (484) 399 31 30
Менингиомы
Симптомы менингиомы
Симптомы заболевания во многом зависят от места локализации опухоли и могут проявляться в виде:
головных болей; нарушения координации движений; глазодвигательных нарушений (косоглазие, двоение, опущение верхнего века); нарушений зрения – снижения остроты или ограничения периферического зрения чувствительных или двигательных нарушений в конечностях противоположной стороны тела, эпилептических приступов различной структуры, психо-эмоциональных нарушений.
Менингиомы больших размеров могут сопровождаться симптомами повышения внутричерепного давления (головная боль с тошнотой и рвотой), могут вызывать клинические симптомы сдавления мозга и ликворопроводящих путей и угрожать жизни пациента.
Диагностика менингиомы
Лечение менингиомы
В настоящее время выделяют несколько основных методов лечения менингиом.
Хирургическое удаление. Успешность хирургического вмешательства зависит от нескольких факторов – от расположения опухоли по отношению к функционально важным отделам мозга, от близости сосудов и черепно-мозговых нервов, а также от размера менингиомы. Оперативное удаление менингиомы в большинстве случаев заканчивается благополучно. Пациенты относительно быстро могут вернуться к нормальному образу жизни. Однако, вероятность рецидива (повторного образования опухоли) может достигать 20% и более в сроки свыше 10 лет наблюдения и зависит в первую очередь от гистологического подтипа опухоли и радикальности ее удаления.
Альтернативой хирургическому вмешательству при лечении менингиом является лучевая терапия. Этот современный метод облучения отлично себя зарекомендовал при лечении опухолей с локализацией в труднодоступных местах, когда удаление сопряжено с высоким риском функциональных нарушений и хирургических осложнений. Лучевой терапии поддаются опухоли различной величины с максимальной точностью, за один раз или несколькими сеансами лечения, необходимых для получения желаемого результата.
Данные литературы свидетельствуют, что контроль роста доброкачественных менингиом составляет 92-95% (т.е. всего 5-8% рецидивов) при наблюдении свыше 10 лет после лучевой терапии с сохранением высокого уровня качества жизни. Менингиомы 2-й и 3-й степени злокачественности рецидивируют чаще, однако важным преимуществом применения лучевой терапии перед другими методами лечения является возможность неоднократного использования и низкий (в сравнении с другими методами) уровень осложнений.
Таким образом, при менингиомах внутричерепной локализации применение лучевой терапии является оптимальным методом лечения, потому что:
ведет к продолжительному контролю опухолевого роста, который проявляется стабилизацией размеров или уменьшением опухоли;
имеет минимальный риск появления новой или усугубления имеющейся неврологической симптоматики;
позволяет быстро вернуться к повседневной жизненной активности.
Лучевая терапия противопоказана при: больших опухолях (должно быть проведено удаление); наличии выраженной неврологической симптоматики связанной или нет с наличием масс-эффекта; опухолях зрительного нерва с сохранным зрением (проводится фракционированное облучение).
Филиалы и отделения, в которых лечат опухоли головного и спинного мозга, а также отделы центральной нервной системы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Микрохирургическое удаление опухолей основания черепа с применением эндоскопической ассистенции
Общая информация
Краткое описание
Задача эндоскопической ассистенции – обеспечить полную визуализацию основных анатомических структур основания черепа, которая недоступна при микроскопической визуализации.
D32.0 Доброкачественное новообразование оболочек головного мозга
D33.0 Доброкачественное новообразование головного мозга над мозговым наметом
D33.1 Доброкачественное новообразование головного мозга под мозговым наметом
D33.2 Доброкачественное новообразование головного мозга неуточненное
D33.3 Доброкачественное новообразование черепных нервов
D33.7 Доброкачественное новообразование других уточненных частей ЦНС
D35.2 Доброкачественное новообразование гипофиза
D35.3 Доброкачественное новообразование краниофарингеального протока
D42.0 Новообразования неопределенного или неизвестного характера оболочек головного мозга
D43.0 Новообразование неопределенного или неизвестного характера над мозговым наметом.
D43.1 Новообразование неопределенного или неизвестного характера под мозговым наметом
D43.3 Новообразование неопределенного или неизвестного характера черепных нервов
D43.7 Новообразование неопределенного или неизвестного характера других частей ЦНС
Q04.8 Другие уточненные врожденные аномалии мозга
G06.0 Внутричерепной абсцесс и гранулема
Сокращения, используемые в протоколе:
АВМ артерио-венозная мальформация
ЗЧЯ Задняя черепная ямка
КТ компьютерная томография
МРТ магнитно-резонансная томография
ОАК общий анализ крови
ОАМ общий анализ мочи
ПЧЯ передняя черепная ямка
ПЭТ позитронно-эмиссионная томография
СЧЯ средняя черепная ямка
ЦНС центральная нервная система
Дата разработки протокола: 2014 год.
Категория пациентов: взрослые.
Пользователи протокола: нейрохирурги, онкологи.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Перечень основных и дополнительных диагностических мероприятий
Основные диагностические мероприятия:
Пчя в медицине что такое
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Краевая клиническая больница, Барнаул
ФГАУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Выбор переднего срединного доступа при опухолях основания черепа
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2017;81(2): 103-114
Гольбин Д. А., Черекаев В. А., Козлов А. В., Паршунина А. М. Выбор переднего срединного доступа при опухолях основания черепа. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2017;81(2):103-114.
Gol’bin D A, Cherekaev V A, Kozlov A V, Parshunina A M. Choosing an anterior midline approach to skull base tumors. Zhurnal Voprosy Neirokhirurgii Imeni N.N. Burdenko. 2017;81(2):103-114.
https://doi.org/10.17116/neiro2017812103-112
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Цель исследования — проанализировать используемые передние срединные доступы к основанию черепа, выявить их положительные и отрицательные стороны и, обобщив данные литературы, представить на суд коллег сформулированный нами алгоритм выбора оптимального доступа. Представлены краткие сведения о технике выполнения доступов, показаниях и противопоказаниях, преимуществах и недостатках. Проанализирован мировой опыт использования обсуждаемых доступов. На основе данных литературы создан прообраз алгоритма выбора оптимального доступа при срединных новообразованиях передних отделов основания черепа. Ситуация выбора оптимального доступа обнаруживает отсутствие четкого понимания о границах между возможностями и ограничениями доступов. Для решения этой проблемы требуется проведение оригинального проспективного исследования.
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Краевая клиническая больница, Барнаул
ФГАУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Выбор хирургического доступа при срединных новообразованиях передних отделов основания черепа зависит не только от многочисленных объективных факторов, включающих особенности заболевания и состояние пациента, но и от предпочтений хирурга, связанных с его квалификацией и субъективными представлениями об оптимальном подходе к той или иной ситуации. Тем более это справедливо в случае, когда хирург владеет разными подходами к лечению одних и тех же видов патологии.
Следует отметить, что на фоне пика популярности экстенсивных базальных доступов хирургическое лечение распространенных опухолей основания черепа было довольно агрессивным. Однако с появлением в конце 90-х годов XX века первых работ по изучению качества жизни пациентов до и после операции в зависимости от выбранного доступа началась переоценка хирургами алгоритмов принятия решения. Новые исследования показали, что оценка качества жизни самим пациентом существенно отличалась от восприятия хирургом результатов своей работы [1]. Текущий этап эволюции хирургии основания черепа характеризуется более консервативной тактикой, быстрым развитием малоинвазивных методов и стремлением к балансу между максимально радикальным удалением опухоли и сохранением высокого уровня качества жизни пациентов.
Цель данного обзора — проанализировать используемые передние срединные доступы к основанию черепа, выявить их положительные и отрицательные стороны и, обобщив данные литературы, представить на суд коллег сформулированный нами алгоритм выбора оптимального доступа.
Классификация передних срединных доступов
Относительно основания передней черепной ямки (ПЧЯ) как границы между внутричерепным пространством и экстракраниальными структурами все передние срединные доступы можно разделить на три большие группы: супрабазальные, трансбазальные и суббазальные [2]. Первые две группы доступов являются транскраниальными и представляют собой различные варианты субфронтальной краниотомии, к третьей группе относятся экстракраниальные доступы [3]. Классификация передних срединных доступов представлена на рис. 1.


Поскольку подробное описание каждого из обсуждаемых доступов не входит в задачи данного обзора, ниже в табл. 1 представлены краткие сведения о технике их выполнения, показаниях и противопоказаниях, преимуществах и недостатках.




Обсуждение
Выбор доступа зависит от многих особенностей опухоли, включая ее гистологическую природу, размеры, место исходного роста, величину внутричерепной и внечерепной частей, консистенцию, степень латерального распространения, наличие интрадурального роста, поражение зрительного пути и передних отделов виллизиева круга, наличие или отсутствие внутричерепной гипертензии, необходимость тракции мозга для подхода к опухоли, техническая сложность пластики дефекта основания черепа и т. д. [2, 46].
Транскраниальные доступы
Транскраниальные доступы, использующие бикоронарный разрез и краниотомию, обеспечивают широкий обзор срединных структур, включая передние отделы основания черепа вплоть до ската, базальные отделы лобных долей, полость носа, околоносовые пазухи, медиальные отделы глазниц и предоставляют возможность одномоментного удаления срединных экстра- и интракраниальных новообразований, более комфортного и эффективного контроля кровотечения, многослойной пластики дефекта основания черепа благодаря доступности надкостницы и других местных аутотканей [10, 16, 19].
Тем не менее расширенные транскраниальные доступы травматичны, следствием их могут быть различные осложнения: некроз скальпа, повреждение лобной ветви лицевого нерва, раневая инфекция, послеоперационные кровотечения и кровоизлияния, напряженная пневмоцефалия, ликворея, менингит, абсцесс мозга, отек мозга, тракционное повреждение мозговой ткани, эпифора, дисфункция экстраокулярных мышц, энофтальм, слепота, эндокринные нарушения, водно-электролитные нарушения, косметические дефекты [6, 13, 35]. Еще одна существенная особенность срединных транскраниальных доступов — невозможность визуализации на ранних этапах операции зрительных путей и передних отделов виллизиева круга, расположенных позади опухоли [3, 10].
Сегодня экстенсивные доступы не используются, их место заняли менее травматичные методики. Главное значение трансбазальных доступов (через лобную пазуху и субкраниального) заключается в том, что они стали альтернативой передней краниофациальной резекции благодаря возможности одномоментного удаления внутри- и внечерепной порций опухоли через один и тот же доступ.
В практике НИИ нейрохирургии им. Н.Н. Бурденко из трансбазальных доступов, обеспечивающих подход к срединным опухолям ПЧЯ с экстра- и интракраниальным распространением, центральное место занял доступ через лобную пазуху [47].
Экстракраниальные доступы
Трансфациальные и сублабиальные доступы в основном использовались при злокачественных опухолях синоназального тракта [3] и представляют теперь по большей части исторический интерес. В настоящее время они почти полностью вытеснены эндоскопическими эндоназальными. Последние стали предметом непрекращающихся дискуссий относительно их возможностей и ограничений, эффективности и безопасности. Накопленный более чем за четверть века опыт позволяет обсуждать преимущества и недостатки эндоскопических трансназальных методов.
В мире предпринимались попытки позиционировать эндоскопический эндоназальный доступ как альтернативу транскраниальным доступам при удалении опухолей ПЧЯ, в частности менингиом [48, 49]. Однако неоспоримым является, что, несмотря на внедрение новых методов пластики дефектов основания черепа васкуляризированными местными тканями [50], ликворея при данном доступе наблюдается достоверно чаще, чем при транскраниальном подходе [28, 36]. По мнению ряда экспертов [31—33], идеальной ситуацией для эндоскопического эндоназального удаления являются срединные новообразования основания черепа с преимущественно экстрадуральным распространением.
Передняя краниофациальная резекция
Эта группа доступов, в основном комбинированных, играет ведущую роль в хирургии срединных злокачественных краниофациальных новообразований, местом исходного роста которых, как правило, является синоназальный тракт. Существуют три варианта передней краниофациальной резекции (ПКФР): классическая, комбинированная «краниоэндоскопическая» и полностью эндоскопическая [38].
Классическая ПКФР, с использованием трансфациального доступа, до сих пор не утратила актуальности, хотя наружные разрезы все чаще замещаются сублабиальным [15, 51]. «Краниоэндоскопический» вариант позволяет с меньшей травматизацией тканей обеспечить визуальный контроль всей опухоли благодаря использованию эндоскопов с разным углом обзора и удалять опухоль одновременно через два доступа за счет параллельной работы двух хирургических бригад [38, 40, 41]. Есть и другой подход: G. Har-El и соавт. [19] утверждают, что первым этапом операции должно быть транскраниальное удаление, а эндоскопическое эндоназальное — вторым. Авторы предлагают после завершения интракраниального этапа укладывать на твердую оболочку лоскут из материала ярко-синего цвета (отсюда и название метода — «the blue-sky technique»). Затем в ходе эндоназального этапа этот материал хорошо виден, что сводит к минимуму риск повреждения твердой мозговой оболочки [52]. Что же касается полностью эндоскопической ПКФР, то к ней отношение такое же, как к эндоскопическим эндоназальным операциям при доброкачественных опухолях основания черепа. Речь идет о тщательном отборе пациентов и специальной подготовке хирургов [38]. Хотя операция начинается с удаления внутренней части опухоли, это не противоречит принципам онкологической хирургии, поскольку границы опухоли с нормальными тканями не нарушаются [43]. В целях достижения онкологической резекции обязательно используется морфологическое «картирование» операционного поля путем множественных биопсий [38]. Также важной технической особенностью эндоскопических операций является соблюдение принципа «следующего пространства»: хирург должен манипулировать в полости, отграниченной костной перегородкой от полости, содержащей опухоль [53]. Например, если опухоль поражает медиальную стенку глазницы, то ее удаляют вместе с интактной периорбитой. Кстати, инфильтрация периорбиты опухолью не является противопоказанием для эндоскопического удаления, однако требуется морфологическая верификация радикальности удаления [54]. Если же невозможно достичь контроля над границами опухоли эндоскопически, то необходимо трансформировать операцию в открытую или выполнить второй этап [45].
Алгоритм выбора доступа
Выбор оптимального хирургического доступа остается одной из основных дискуссионных проблем в хирургии основания черепа. Логично, что при экстрадуральных новообразованиях предпочтителен экстрадуральный доступ, а интракраниальную часть опухоли сравнительно легче и безопаснее удалить с помощью транскраниального доступа. Радикальное удаление внутричерепной порции опухоли путем краниотомии проще и доступнее, чем с помощью эндоскопического эндоназального доступа. Кроме того, при бикоронарном разрезе хирург располагает обилием тканей для пластической реконструкции дефекта основания черепа с помощью свободных или перемещенных лоскутов на питающей ножке [36, 55].
Решение о выборе доступа должно основываться не только на возможности радикального удаления новообразования, но и на сохранении качества жизни пациента на уровне не ниже исходного. Безопасность операции не должна быть принесена в жертву радикальности. Стремление к тотальному удалению опухоли может привести к осложнениям и ухудшению состояния пациента после операции, поэтому хирург в соответствующий момент должен прекратить удаление, чтобы затем провести лучевое лечение для достижения контроля над ростом опухоли и сохранения качества жизни пациента как минимум на дооперационном уровне [56].
Анализ данных литературы позволил создать прообраз алгоритма выбора оптимального доступа при срединных новообразованиях передних отделов основания черепа (рис. 3). Нижняя часть этого алгоритма выявляет отсутствие четкого понимания о границах между возможностями и ограничениями доступов. Совершенно очевидно, что для решения этих вопросов требуется проведение оригинального проспективного исследования. Ожидается, что его результаты позволят уточнить показания к различным доступам и оптимизировать процесс их выбора в интересах исхода лечения и качества жизни пациентов.