Пурины и пиримидины что это
Пурины и пиримидины что это
Комплексный анализ концентрации азотистых оснований, нуклеозидов и их основных промежуточных и конечных метаболитов, используемый для диагностики врождённых болезней обмена пуринов и пиримидинов.
Анализ крови при нарушениях метаболизма азотистых оснований и их метаболитов
Синонимы английские
Laboratory diagnostics of inborn errors of purine and pyrimidine metabolism
Высокоэффективная жидкостная хроматография-масс-спектрометрия (ВЭЖХ-МС)
Нмоль/мл (наномоль на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Пурины и пиримидины являются абсолютно незаменимыми компонентами клеток: они необходимы для синтеза ДНК и РНК, запасания и транспорта энергии, формирования коэнзимов и метаболитов синтеза фосфолипидов и углеводов, а также передачи сигнала в клетку и его преобразования. Учитывая такие разнообразные функции пуринов и пиримидинов, становится ясным, почему нарушения их обмена приводят к одновременному поражению сразу нескольких систем органов. Чаще эти нарушения обусловлены недостаточностью ферментов, необходимых для нормального метаболизма пуринов и пиримидинов, носят врождённый характер и проявляются в младенческом или раннем детском возрасте, хотя некоторые из них манифестируют уже во взрослом возрасте. На сегодняшний день известно около 30 таких нарушений, 17 из которых приводят к заболеваниям.
Несмотря на то что существуют некоторые закономерности в клинической картине этих врождённых болезней (например, частое поражение нервной системы и задержка умственного развития при нарушении обмена пиримидинов), клиническая картина многих из этих нарушений не имеет каких-либо специфических признаков. Все эти болезни могут быть очень похожи друг на друга. В связи с этим диагностировать эти заболевания, а тем более различить их между собой на основании только лишь симптомов невозможно. С другой стороны, своевременная диагностика этих заболеваний очень важна, так как она позволяет провести генетическое консультирование и в некоторых случаях начать терапию, которая может полностью избавить пациента от симптомов. Основным и единственным методом окончательной диагностики нарушений метаболизма пуринов и пиримидинов является лабораторный метод, в ходе которого одновременно исследуют пурины и пиримидины и все их метаболиты, известные на данный момент и значимые в клиническом плане.
В настоящий момент не существует более или менее четких указаний относительно того, в каких группах пациентов следует проводить исследование на пурины/пиримидины и их метаболиты. Учитывая разнообразную клиническую картину этих заболеваний, назначить этот анализ может практически любой специалист.
Ежегодно обнаруживают новые нарушения метаболизма пуринов и пиримидинов. В это комплексное исследование включены основные метаболиты, хотя все же не все. Поэтому нормальный результат этого исследования не может однозначно исключить наличие какого-либо заболевания из этой группы.
В некоторых случаях комплексный лабораторный анализ выявляет нарушения метаболизма пуринов и пиримидинов, которые, однако, никак не проявляются и клинического значения не имеют.
Следует отметить, что при обследовании пациента с подозрением на нарушение метаболизма пуринов и пиримидинов в большинстве случаев требуются дополнительные лабораторные тесты, с помощью которых удается оценить степень тяжести повреждения органов и тканей.
Для чего используется исследование?
Когда назначается исследование?
Диагностика нарушения обмена пуринов и пиримидинов в моче
Пурины и пиримидины – органические вещества, входящие в структуру нуклеиновых кислот, коферментов и макроэргических соединений. Нарушение метаболизма азотистых оснований возникает вследствие генетически обусловленных дефектов ферментов, участвующих в обмене пуринов и пиримидинов.
Наследственные дефекты метаболизма азотистых оснований.
Purine and Pyrimidine Panel, Urine.
Высокоэффективная жидкостная хроматография-масс-спектрометрия (ВЭЖХ-МС).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Исключить физическое и эмоциональное перенапряжение во время сбора суточной мочи (в течение суток).
Общая информация об исследовании
Пурины и пиримидины – гетероциклические органические азотистые вещества, входящие в состав нуклеотидов и нуклеозидов. Они являются важными структурными элементами нуклеиновых кислот (ДНК, РНК), источников энергии (например, АТФ), ферментов (НАДФ, НАД, ФАД).
К пуринам относится аденин, гуанин, ксантин, гипоксантин, к пиримидинам – урацил, тимин, цитозин, оротовая кислота. Данные вещества необходимы для хранения, транскрипции и трансляции генетической информации, роста и деления клеток, накопления энергии, передачи сигналов. В организме человека происходит эндогенный синтез пуринов и пиримидинов, взаимное превращение нуклеозидов и нуклеотидов и их катаболизм. Конечным продуктом метаболизма пуринов является мочевая кислота (2,6,8-триоксипурин). Пиримидины деградируют до бета-аланина и бета-аминоизобутирата.
Дефекты ферментов, принимающих участие в разных этапах метаболизма пуринов и пиримидинов, могут приводить к развитию заболевания. Патогенез данных состояний связан с накоплением в клетках и биологических жидкостях избыточного количества азотистых оснований и их метаболитов, которые могут быть токсичными и способными повреждать генетический материал и функцию клеток. Описано около 30 нарушений различных этапов метаболизма пуринов и пиримидинов, но клинически проявляются только 17. Основные лабораторные признаки данных заболеваний – это изменение содержания пуринов и пиримидинов в биологических жидкостях. Первые симптомы могут возникать как в раннем детстве, так и в старшем возрасте, а клинические проявления могут значительно варьироваться по степени тяжести. Наиболее часто при патологии пуринового и пиримидинового обмена повреждаются нервная система (задержка развития, аутизм, эпилептические приступы), кроветворная ткань (анемия) и почки (нефропатия, мочекаменная болезнь).
Классическим примером приобретенного нарушения пуринового обмена является подагра – заболевание, сопровождающиеся повышением уровня мочевой кислоты в крови и отложением уратов в тканях. Однако необходимо учитывать, что гиперурикемия (повышение уровня мочевой кислоты в крови) у людей старше 40 лет связана не только с генетической предрасположенностью, но и с особенностями питания, употреблением алкоголя, нарушением экскреторной функции почек. Гиперурикемия и подагра в более молодом или детском возрасте в большинстве случаев ассоциированы с наследственными дефектами ферментов пуринового обмена.
Тяжелое нарушение метаболизма пуринов – синдром Леша – Нихана (абсолютный дефицит гипоксантин-гуанин-фосфорибозилтрансферазы), который наследуется совместно с Х-хромосомой и проявляется тяжелыми неврологическими нарушениями, задержкой психомоторного развития, церебральным параличом, аутоагрессивным поведением и уратной нефропатией. Симптомы заболевания чаще становятся заметными в возрасте 3-12 месяцев. При данной патологии в биологических жидкостях возрастает концентрация мочевой кислоты и гипоксантина.
К врожденным нарушениям пуринового обмена относятся дегидроксиаденинурия, наследственная ксантинурия, синдром Келли – Зигмиллера и др. Дефицит аденозин-дезаминазы и пурин-нуклеозид-фосфорилазы приводит не только к неврологическим нарушениям, но и к снижению количества лимфоцитов и иммунодефициту, который проявляется рецидивирующими тяжелыми инфекциями.
Патология пиримидинового обмена наблюдается и диагностируется значительно реже. К нарушениям метаболизма пиримидинов относятся оротовая ацидурия, дефицит пиримидин-5-нуклеотидазы, дефицит дигидропиримидин-дегидрогеназы.
Некоторые из наследственных нарушений обмена азотистых оснований при своевременном выявлении поддаются коррекции, для других применяется симптоматическая терапия и разрабатываются новые методы лечения. Диагноз верифицируется на основании комплексных клинико-генеалогических данных и результатов лабораторного исследования.
Для чего используется исследование?
Когда назначается исследование?
Метаболизм азотистых оснований
Статья будет посвящена базовому, но крайне интересному разделу биохимии — метаболизму азотистых оснований. Сегодня мы рассмотрим то, как из аминокислот и глюкозы получается материал, кодирующий нашу биологическую сущность, — нуклеиновые кислоты (ДНК и РНК). Это понадобится нам для понимания очень важных вещей. Например, как одна мутация в метаболизме нуклеотидов способна подарить ребенку тяжелейший иммунодефицит или сделать из него глубокого инвалида. Почему не живут долго и счастливо многие из тех, кто злоупотребляет вином, красным мясом, шоколадом и прочими радостями. Почему иногда умирают (во всяком случае, часто умирали раньше) при проведении противоопухолевой химиотерапии. В статье, посвященной нарушению метаболизма азотистых оснований, ты узнаешь и о редких заболеваниях, о которых забывают 90 % врачей, принимая их за другие, более известные и очевидные. Но для начала надо постичь базу, ведь без понимания метаболизма азотистых оснований перечисленные мною факты и заболевания будет крайне сложно понять. Приступим.
Немного терминологии
Нуклеотидом мы будем называть соединение, представляющее собой совокупность трех частей [3]:
Уберем фосфат — получим нуклеозид. Уберем еще и рибозу и получим азотистое основание — пуриновое или пиримидиновое «кольцо». Эта терминология необходима для понимания названий целого ряда ферментов, которыми сегодня мы будем развлекать наш мозг.
Попадая в твой ЖКТ, в 12-перстную кишку, нуклеиновые кислоты, содержащиеся в пище, расщепляются рибонуклеазами, нуклеотидазами и прочими ферментами поджелудочной железы. Продукты расщепления в виде нуклеотидов и нуклеозидов (иногда и вовсе азотистых оснований) попадают в энтероциты (клетки слизистой оболочки тонкой кишки).
В энтероцитах есть ксантиноксидаза, которая переводит пурины (аденин, гуанин) в мочевую кислоту. Мочевая кислота, как правило, стремится всосаться в кровь и выйти с мочой через почки. Может также пропустить себя в просвет кишки и выйти с калом (кстати, это бывает и весьма ощутимо, если имеется декомпенсированная патология почек).
Пиримидины утилизируются своим путем [1, 3], о котором мы поговорим позже. Но главное, что ты должен понять: экзогенных источников нуклеотидов для организма нет. Нуклеотиды, попадающие с пищей, не усваиваются, а лишь дают некоторое количество уратов — солей мочевой кислоты. Не перевелись еще люди, которые ведут активную пропаганду «Нет ГМО» и осуществляют на этом нехилую спекуляцию при продаже пищевых продуктов. Пусть в пище будет хоть трижды перекрещенная и модифицированная ДНК, твоя кишка все равно превратит все в кусок химуса и уратов, и ты даже не поймешь, что съел шедевр генной инженерии…
Образование пуринов. «Откуда же тогда взять мономеры для нуклеиновых кислот? Как и откуда берутся нуклеотиды? Как они используются дальше?» — и еще тысяча вопросов, которые добровольно не пришли бы в твою голову, если бы не предстоящий зачет по биохимии. Именно на них мы будем искать ответ.
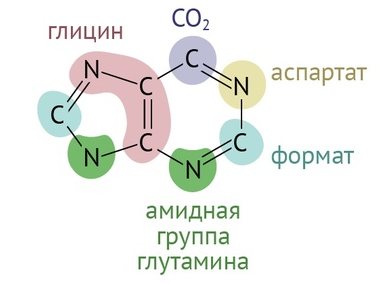
Пурины — гуанин и аденин — формируются буквально из ничего. Все, что нам нужно для создания пуринового кольца — глюкоза (поступающая в пентозо-фосфатный цикл), глицин, две молекулы глутамина, одна молекула аспартата, пара молекул активной метилированной формы фолиевой кислоты + немного терпения и приправы в виде пяти молекул АТФ [1].
Я не хочу грузить тебя серией реакций синтеза пуринов, ее на экзамене полностью никто не спросит, и, скорее всего, для принятия решений в своей работе она тебе тоже не нужна. Но кое-что ты знать должен.
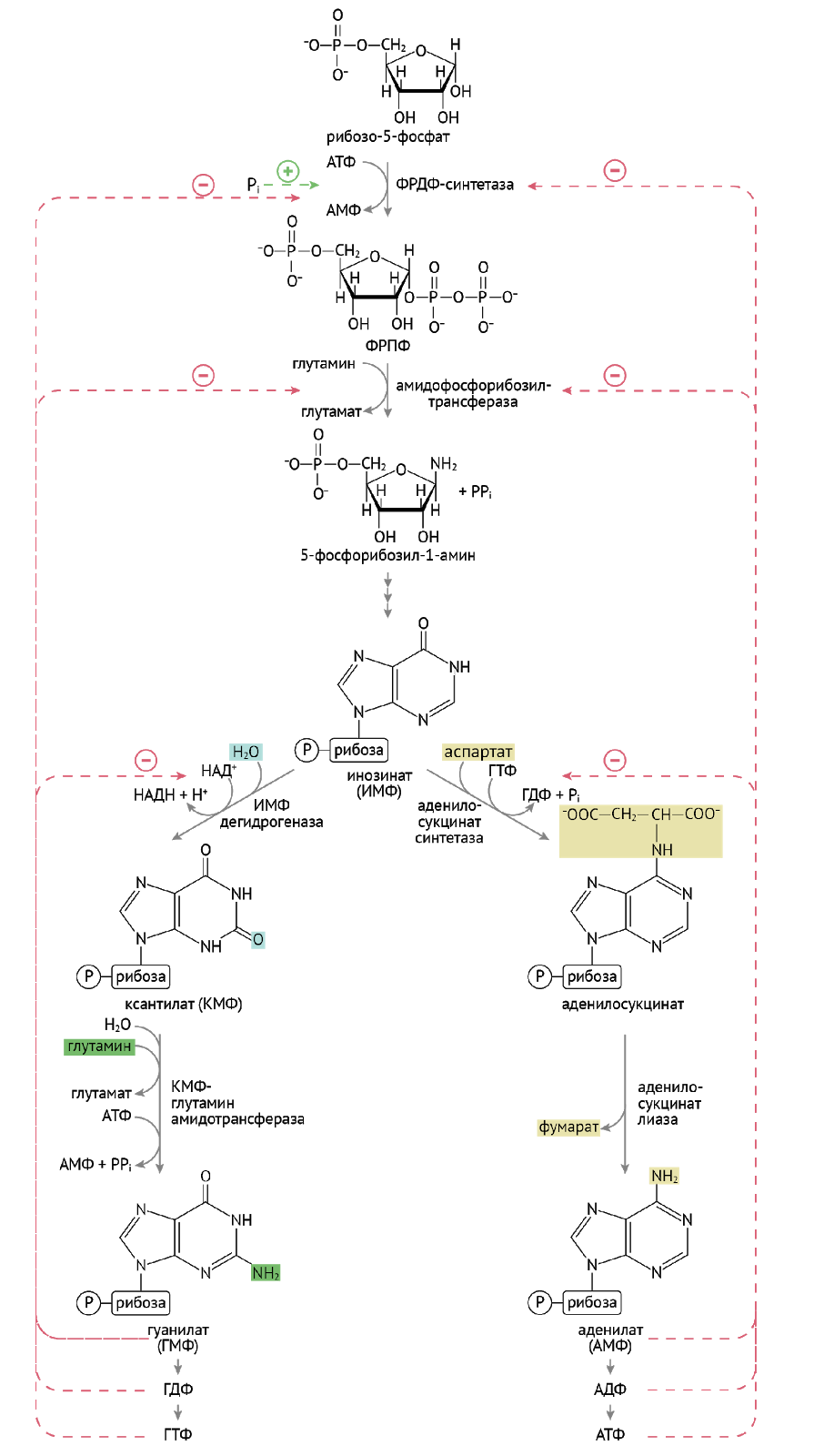
Синтез пуринов проходит два основных этапа: формирование инозинмонофосфата (ИМФ) и получение из ИМФ таких нуклеотидов, как ГМФ и АМФ.
Необходимо знать ключевые моменты этого синтеза.
Первый из них — лимитирующая реакция синтеза пуринов — формирование фосфорибозилпирофосфата (ФРПФ).
(Для тех, кто не понял: лимитирующая реакция — это та реакция, скорость которой определяет скорость всего процесса, а также та, что подвергается наиболее жесткой и сложной регуляции).
Далее следует еще порядка девяти реакций, которые из 5-фосфорибозил-1-амина сделают инозинмонофосфат (ИМФ). На этом закончится первый этап синтеза. Для экзамена и последующей работы тебе нужно знать, какие молекулы участвуют в формировании пуринового кольца, и эти две реакции. Для жизни — и того меньше.
2 этап. Чрезвычайно важен и интересен. Два брата, два параллельно идущих, как ты со своим другом, ̶п̶о̶ ̶н̶а̶к̶л̶о̶н̶н̶о̶й̶ к синтезу АМФ и ГМФ.
Что интересно: конечные продукты этого чрезвычайно интересного (никому) синтеза — ГТФ и АТФ — помогают дружественному параллельному циклу, даруя энергию для синтеза нуклеотида. Несколько ниже приведена иллюстрация вышеописанных биохимических событий.
Распад пуринов и дальнейшая судьба одиноких азотистых оснований
Катаболизм пуринов не менее важная и интересная серия процессов, потому что так же, как и синтез пуринов, их катаболизм является ключевым моментом для понимания патогенеза ряда заболеваний. Большинство нуклеотидов подвергаются повторному использованию (отдать некому, выкинуть жалко), заново включаясь в синтез нуклеотидов. Проследим путь их катаболизма.
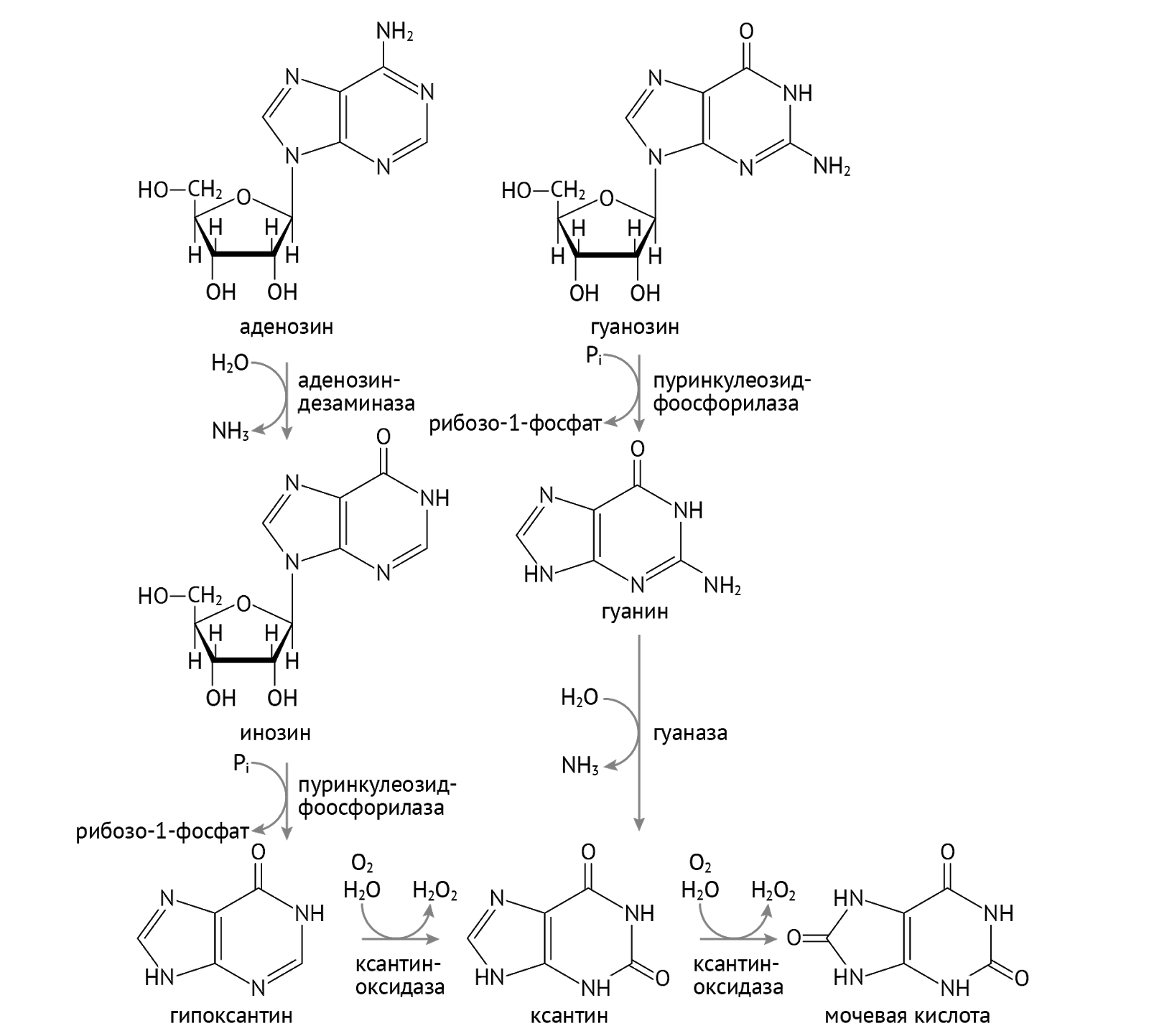
Как мы видим, аденозин (аденин + рибоза) стремится стать гипоксантином. Но на пути к этому ему нужно перевоплотиться назад в инозинмонофосфат. В этом ему поможет аденозиндезаминаза. Хорошо запомни этот фермент, мы к нему не раз еще вернемся. Гипоксантин, кстати, может стать просто ксантином, чем обязан ксантиноксидазе.
Гуанозин считает стадию гипоксантина для себя недостойным (не может смириться с тем, что именно АТФ, а не ГТФ, является основным источником энергии в клетке, старые обиды несчастной молекулы). В силу этого ГТФ не церемонится и становится ксантином, минуя стадию образования гипоксантина. И здесь перед ним встает выбор из двух путей. Путь 1: гипоксантин и ксантин станут мочевой кислотой и оставят после себя лишь воспоминания, удалившись в мочу (или в суставы и почечные канальцы в виде уратов). Путь 2: камбэкнуться в ИМФ (а затем в АМФ) и ГМФ. В этом им поможет братан, которого во дворе прозвали гипоксантингуанинфосфорибозил-трансферазой (ГГФРТ).
Получившиеся вновь ГМФ и ИМФ (🡪 АМФ) превращаются в ГТФ и АТФ путем присоединения фосфорных остатков. Здесь все просто.
Резюме: для нас клиническое значение будут иметь нижеперечисленные ферменты:
Их значение для реализации той или иной патологии будет обсуждаться в соответствующей статье.
Синтез пиримидинов
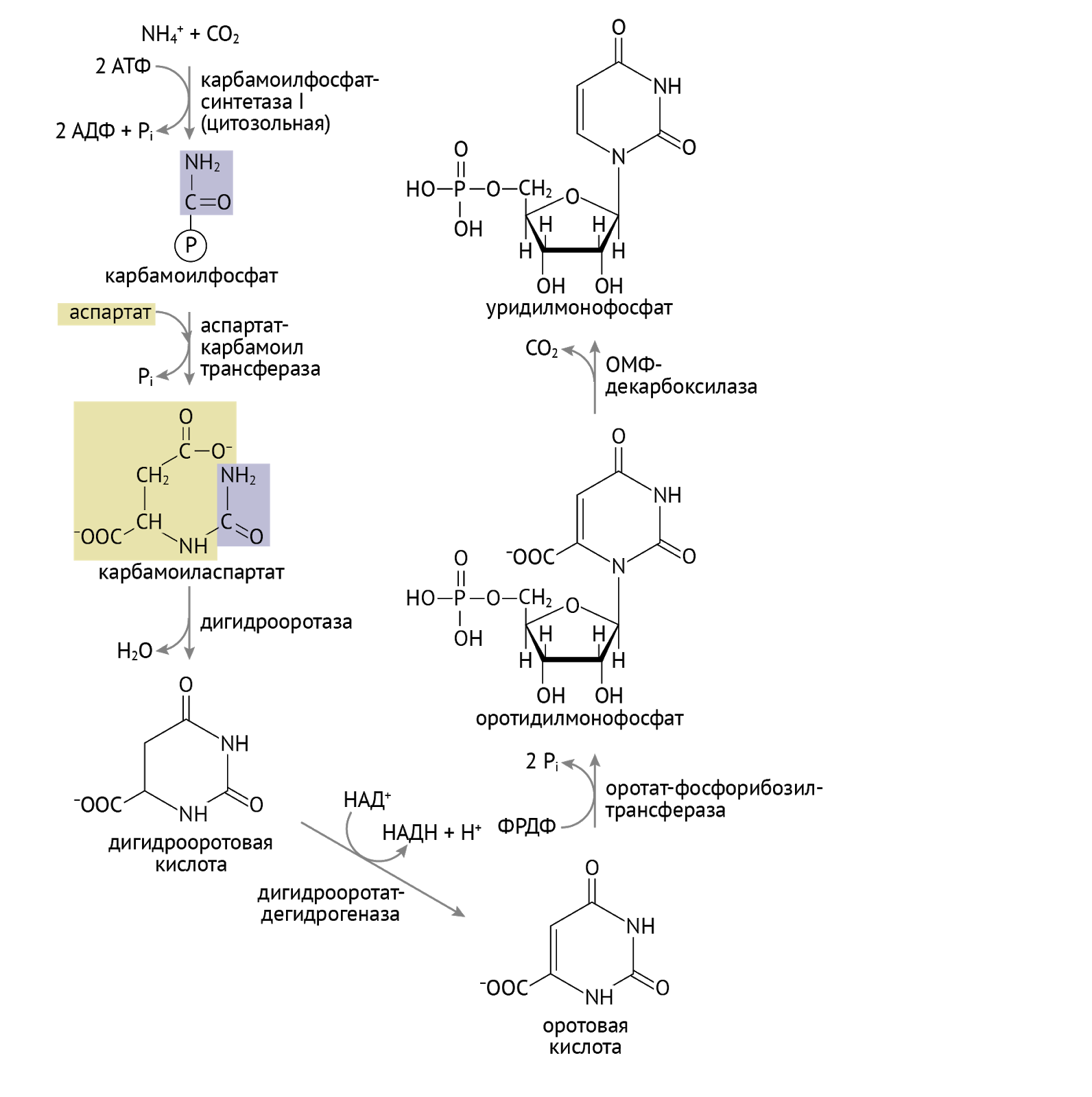
Здесь все проще и сложнее одновременно. Реакций здесь меньше, они понятнее, а значит, тебя могут спросить их на экзамене. Не пугайся, а просто смотри и запоминай.
С карбомоилфосфатом мы еще встретимся. Забегая далеко вперед (дальше, чем твое отчисление) сообщу тебе, что это соединение – исходный продукт для синтеза мочевины в печени. Той самой мочевины, в которую превращается весь «вредный» азот в организме. Советую отнестись внимательнее к следующим ферментам: оротатфосфорибозил-трасфераза и оротатмонофосфат (ОМФ)-декарбоксилаза. Нарушение их функции — ключевой момент в реализации такого патологического состояния, как оротовая ацидурия.
Взглянув на схему, мы видим, что конечным продуктом этого этапа является уридинмонофосфат (УМФ). С обостренным чувством собственной важности УМФ дает начало:
Все образованные соединения — АТФ, ГТФ, ЦТФ, УТФ — используются для синтеза рибонуклеиновых кислот, функцию которых ты должен был помнить не давеча как с третьего класса средней школы. Они имеют важное значение в матричных биосинтезах: в транскрипции ДНК, синтезе белка.
Но у нас есть еще и ДНК. Та штука, которая определяет твой фенотип и все, что из него вытекает. ДНК-полимераза установила фейс-контроль для синтеза ДНК. Он заключается в том, что все субстраты должны быть дезоксирибонуклеотидом [1, 3].
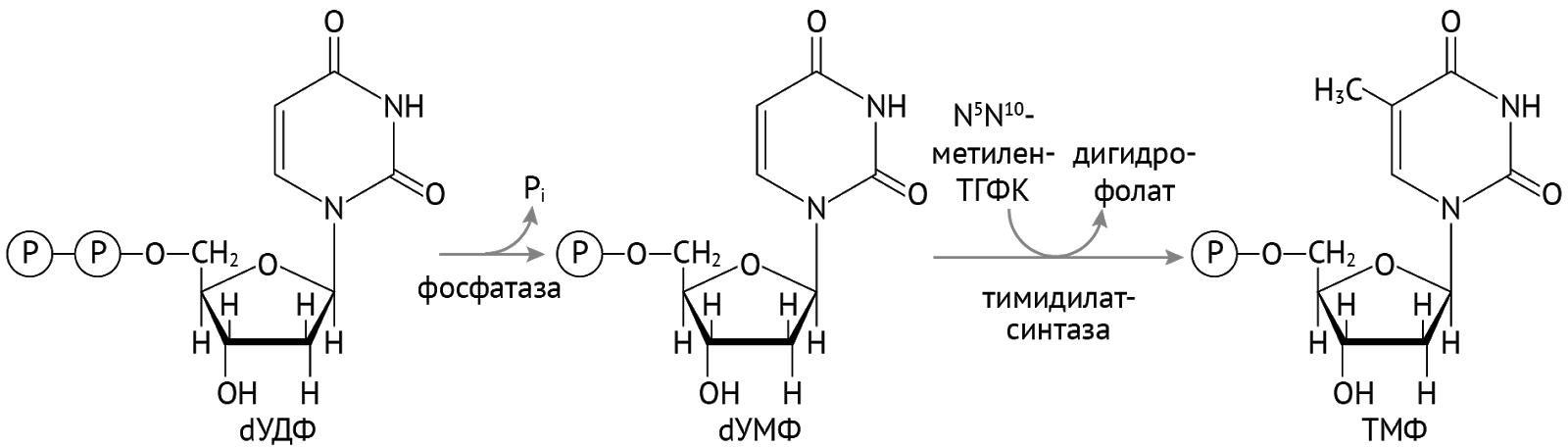
Есть исключение из правил. Это касается УТФ. Чтобы попасть в ДНК, ему нужно притвориться не просто дезоксирибонуклеотидом. Ему нужно притвориться ТТФ (тимидинтрифосфат). Что он и делает:
Далее остается присоединить остатки фосфорной кислоты и получить тимидинтрифосфат [1].
Важно отметить, что тимидилатсинтаза и реакция образования ТМФ являются чрезвычайно важными в отношении синтеза ДНК. Также здесь можно заметить, что необходимым кофактором является тетрагидрофолиевая кислота.
Именно данная реакция является мишенью метотрексата — цитостатического противоопухолевого препарата, являющегося антиметаболитом — структурным аналогом фолиевой кислоты, который проявляет к тимидилатсинтазе недвусмысленное сродство. Связываясь с ней, метотрексат останавливает реакцию образования ТМФ, тем самым обрывая синтез ДНК в самом зародыше — на этапе образования ее структурных компонентов. Метотрексат нашел применения в онкологии (преимущественно при гемобластозах) и в ревматологии (ревматоидный артрит [5]).
Распад пиримидинов
В нашей жизни ничего не вечно. Пиримидины тоже гибнут, но распадаясь, оставляют после себя ряд предшественников, которые участвуют в метаболизме, но уже другими путями.
Комментируя сложную схему распада пиримидинов, я акцентирую внимание на двух важных вещах:
Биологическое значение нуклеотидов в клетках. Функции, выходящие за рамки синтеза нуклеиновых кислот
Обсудив с тобой предметы сложной и высокой материи, мы переходим к самому интересному и «вкусному» (только не блевани) разделу настоящей статьи.
Нуклеотиды являются кирпичами для нуклеиновых кислот, что важно для реализации генетической информации и превращения ее в реальный фенотип со своими уникальными морфологическими особенностями. Этот процесс заслуживает отдельной лекции (спойлер — она следующая).
Но этим не исчерпывается значение нуклеотидов.
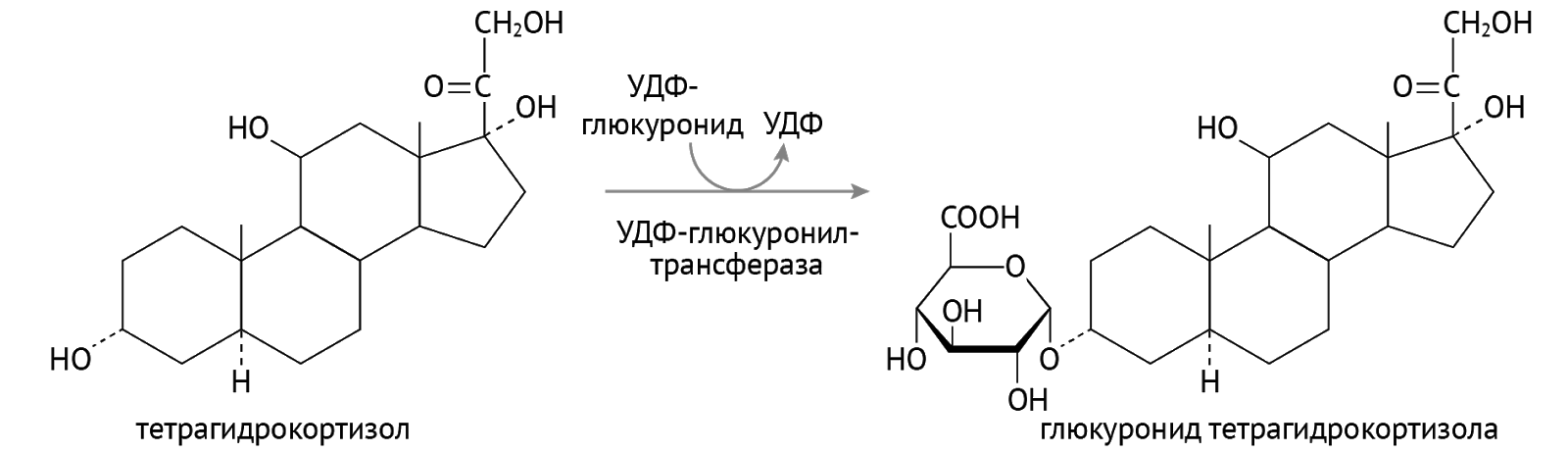
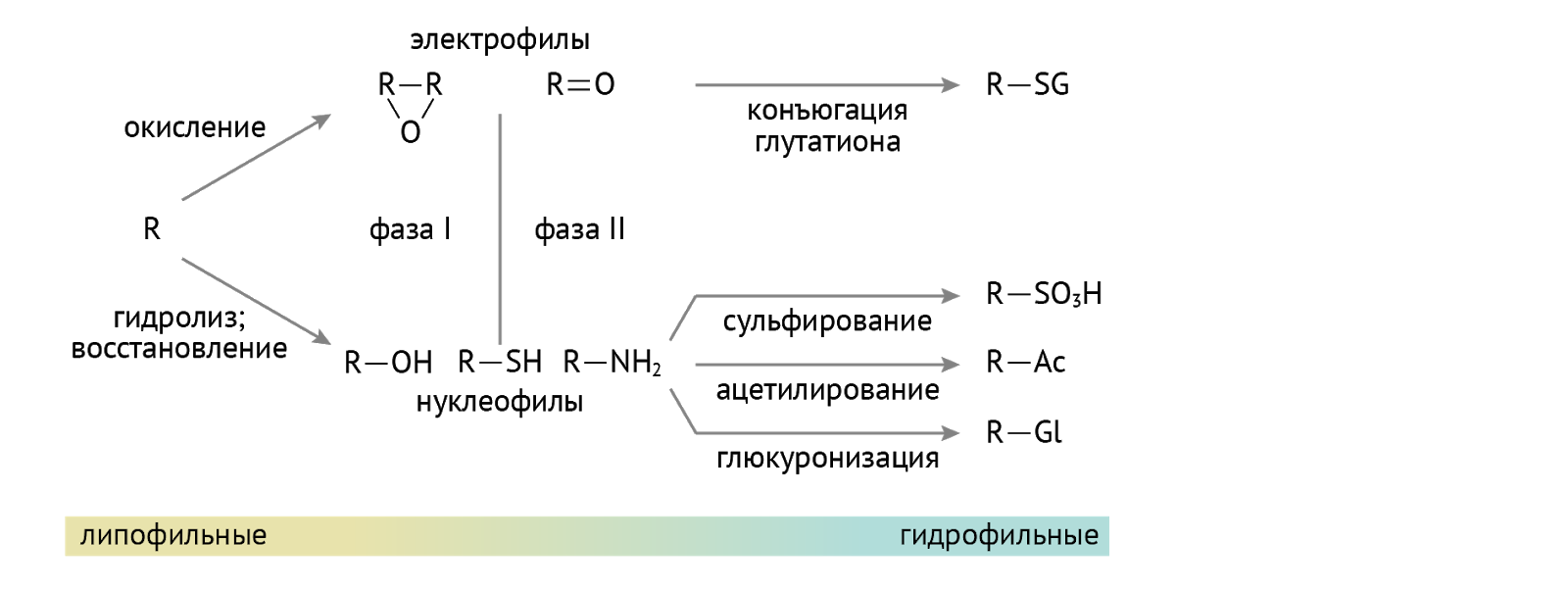
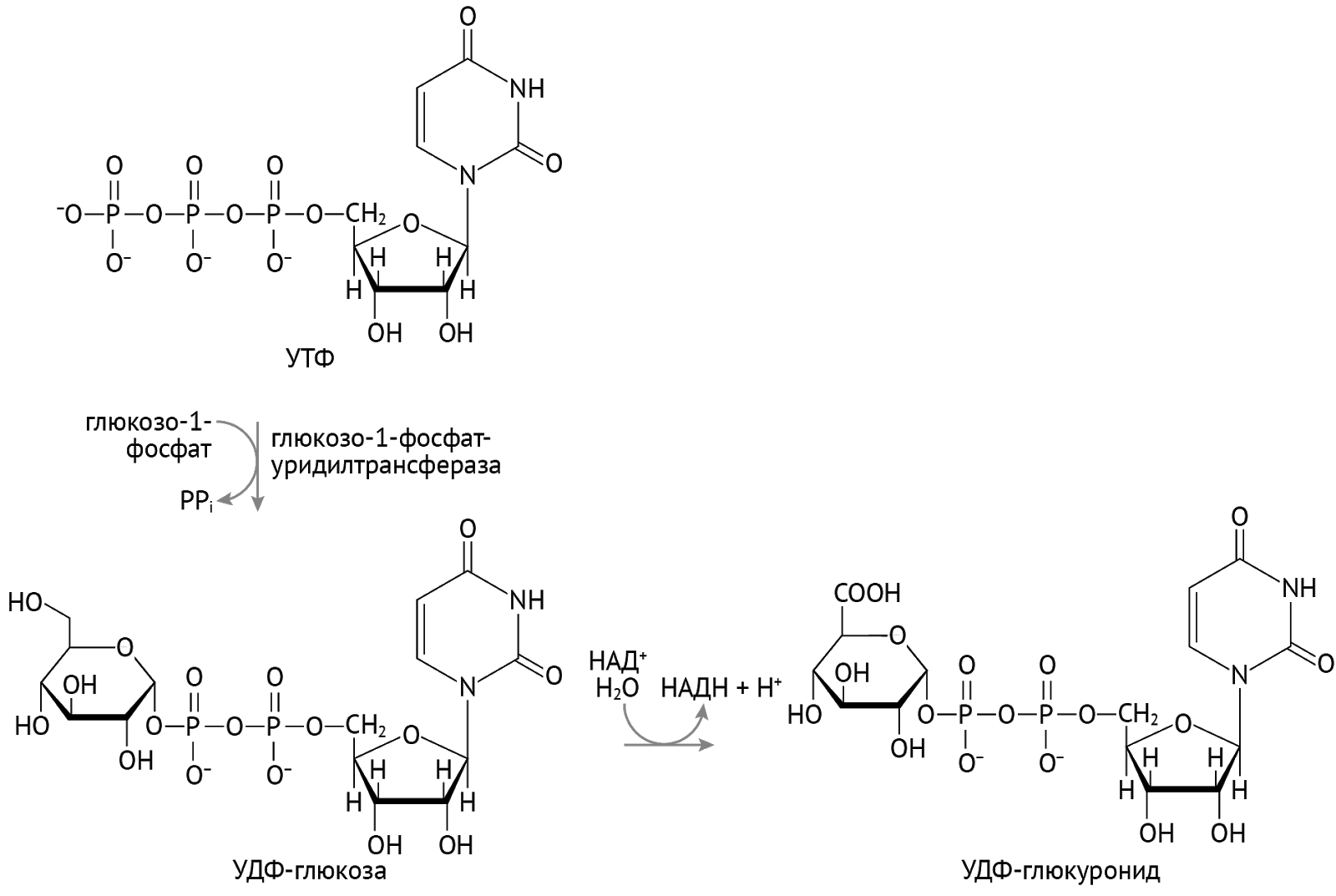
Детоксикация. Кое-кто из них используется в организме для детоксикации ксенобиотиков — лекарств, токсинов и иных химикатов, поступающих в организм, а также для детоксикации липофильных (т. е. растворимых в липидах и нерастворимых в воде) соединений: гормонов, билирубина. Суть детоксикации (обезвреживания) — перевести плохо растворимое в воде вещество в хорошо растворимое, что необходимо для последующего выведения через почки с мочой из организма. Достигается это присоединением полярной химической группы к исходному хулигану. Сначала формируется гидроксильная группа (если таковой нет, это этап образования более полярных соединений). А затем наступает этап конъюгации… Посмотрим, как это выходит на примере тетрагидрокортизола (рис. 11) [2].
А вот схема для менее дотошных, чем автор данной лекции.
Никто: «Ух ты, классно и понятно».
Твой экзаменатор: «А откуда ты возьмешь такую форму нуклеотида, которая будет способна конъюгировать с ксенобиотиками?».
Ты:
Важное значение эта форма УДФ имеет и для метаболизма билирубина: благодаря УДФ-диглюкурониду токсичный липофильный билирубин становится полярным, растворимым в крови и моче, конъюгированным билирубином [1, 2].
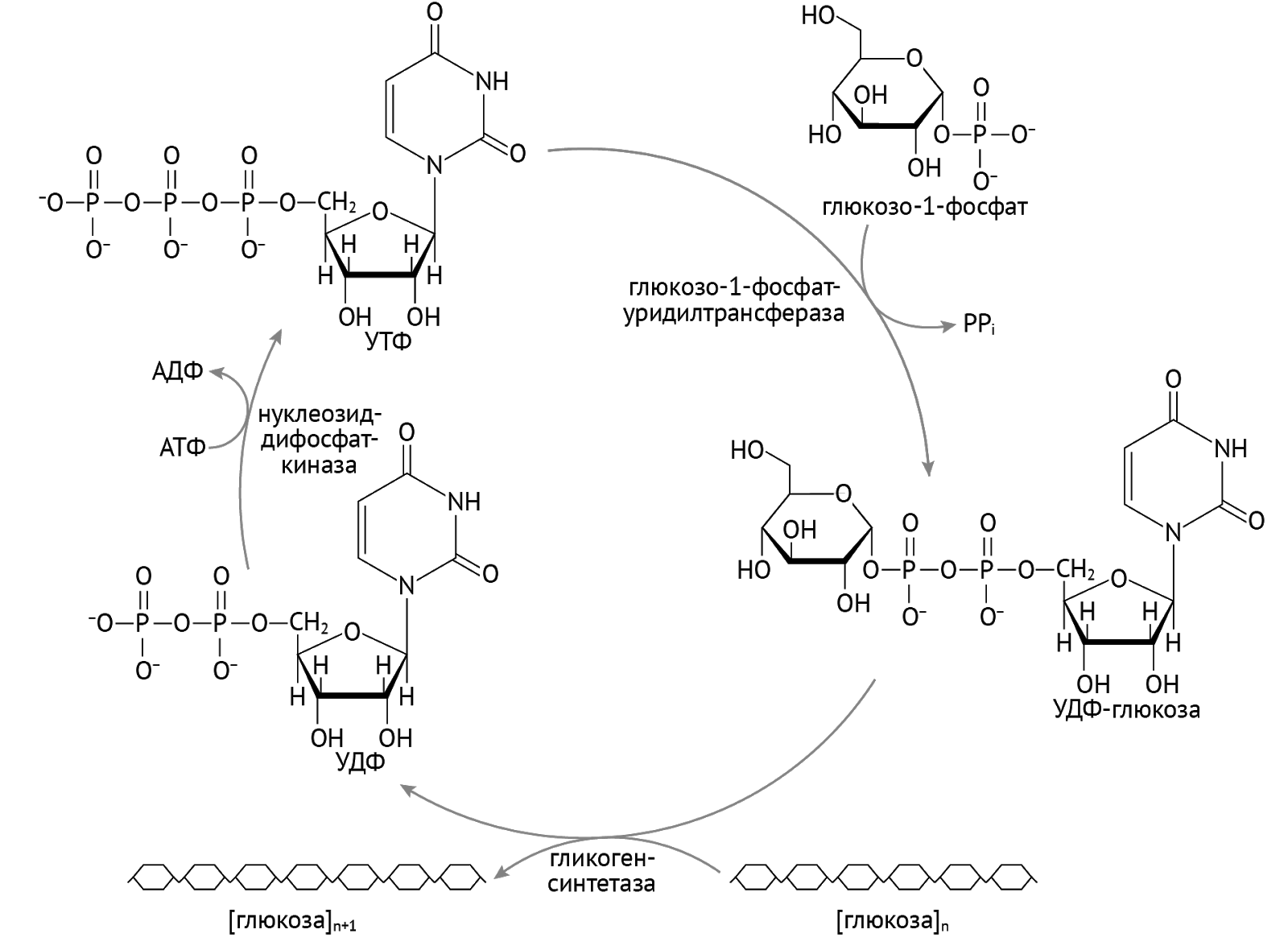
Гликоген. Неоценимое значение УДФ имеет и для образования гликогена.
Гликоген — это сравнительно инертная макромолекула, которая является резервуаром источника энергии в печени и мышцах. Через восприятия сигнала от инсулина глюкоза посредством активации (в виде присоединения фосфорного остатка и изомеризации) прыгает на гликоген благодаря посредничеству УТФ [1].
Вторичные сигнальные молекулы. Нуклеотиды, в частности, цАМФ и цГМФ, играют важную роль в процессе реализации клеточных функций и межклеточного взаимодействия. Клетка, будучи кирпичом биологического коммунизма, воспринимает сигналы от вышестоящих регуляторных систем, которые контролируют ее деятельность.
Это может выражаться в:
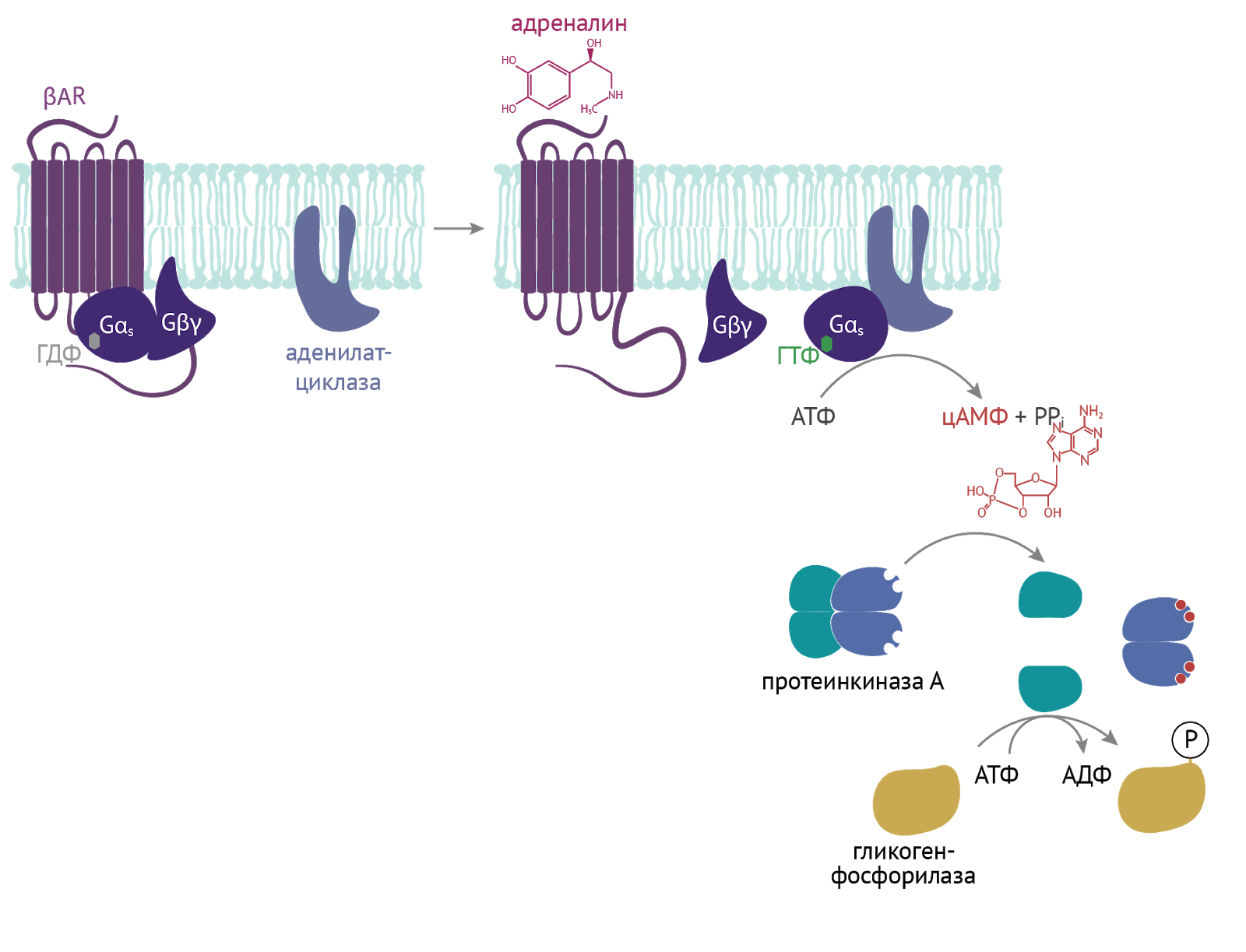
Такие молекулы, как цАМФ и цГМФ, являются одними из важных вторичных мессенджеров. Клетка, воспринимая сигнал извне (будь то гормон, нейромедиатор или любой другой разбойник), изменяет внутри себя концентрацию этих мессенджеров. Те вмешиваются в серию внутриклеточных последовательных реакций и тем самым усиливают первоначальный сигнал [4].
Здесь пример воздействия адреналина на метаболизм гликогена. Концентрация цАМФ растет, что приводит к активации протеинкиназы А. Та активирует гликогенфосфорилазу, что приводит к высвобождению из гликогена глюкозы и получению дополнительного источника энергии для выполнения различных нужд организма [4].
Примеров, когда нуклеотиды играют важную роль в организме, чрезвычайно много. Вспомнить хотя бы о том, кто в клетках является главным источником энергии (АТФ). Нуклеотиды в ходе своего метаболизма могут становиться источником иных метаболитов, которые могут принимать участие в энергетическом метаболизме (α-кетоглутарат, пировиноградная кислота 🡪 ацетил-Коа) и так до бесконечности. Придет время, и мы обсудим те случаи, когда метаболизм пуринов и пиримидинов в силу тех или иных причин нарушается [1].
Иногда это имеет очень серьезные последствия…
Пурины и пиримидины что это
Метаболизм пуринов – совокупность протекающих в живых организмах процессов синтеза, превращений и катаболизма пуриновых производных. Пуриновый обмен имеет чрезвычайно сложную и до сих пор еще недостаточно изученную систему регуляции. Накопились многочисленные результаты исследований, свидетельствующие, что нарушения регуляции играют важную роль в возникновении и развитии заболеваний, связанных с метаболизмом пуринов.
Цель настоящего обзора – обобщение и систематизация литературных данных о механизмах регуляции пуринового обмена, нарушения которых могут лежать в основе заболеваний человека.
Пуриновые производные выполняют в организме множество функций: участвуют в синтезе и метаболизме нуклеиновых кислот, нуклеотидных коферментов (флавинадениндинуклеотид, никотинамидадениндинуклеотид (НАД), никотинамидадениндинуклеотидфосфат и др.), в энергетическом обмене (аденозинтрифосфат (АТФ), аденозиндифосфат (АДФ) и аденозинмонофосфат (АМФ), гуанозинтрифосфат (ГТФ), гуанозиндифосфат (ГДФ) и гуанозинмонофосфат (ГМФ)), в передаче сигналов в клетку (циклические АМФ и ГМФ), в образовании активных форм различных веществ: углеводов (ГДФ-манноза), сульфата (фосфоаденозинфосфосульфат), метионина (S-аденозилметионин) [1; 2]. Известно, что по содержанию в различных органах и тканях человека и животных пуриновые мононуклеотиды преобладают над другими свободными нуклеотидами – пиримидиновыми, пиридиновыми [3–5]. Имеются прямые указания на связь функций мозга с концентрацией пуриновых метаболитов в спинномозговой жидкости. Кроме того, некоторые из них оказывают прямое регуляторное действие на тканевом уровне, как, например, аденозин, обладающий свойством вазодилататора и эндогенного антиконвульсанта [1].
Большая часть пуринов в организме образуется путем биосинтеза denovo, который представляет собой многоступенчатый процесс образования пуринового гетероцикла из низкомолекулярных предшественников. Ткани, неспособные к синтезу пуринов denovo, (эритроциты, полиморфноядерные лейкоциты, частично мозг и периферические лимфоциты), обеспечиваются пуринами в основном из печени [2; 6]. Небольшая часть готовых пуриновых гетероциклов берется организмом из пищи. Но, согласно [6], пищевые пурины не включаются ни в нуклеиновые кислоты человека, ни в его коферменты, такие как АТФ или НАД. При этом известно, что 30 % выводимой из организма мочевой кислоты – конечного продукта пуринового обмена у человека, происходит из пуринов пищи [7]. Примерно две трети мочевой кислоты выводится у человека с мочой, оставшаяся треть главным образом выделяется в кишечник (с желчью, слюной и желудочным соком) и там частично распадается, а частично всасывается обратно в кровь [4; 6; 7].
К заболеваниям, которые связаны с нарушениями обмена пуринов, относятся подагра, болезнь Lesch-Nyhan, синдром Kelley-Seegmiller, повышенная активность или изменение свойств фосфорибозилдифосфатсинтазы (ФРДФ-синтетазы), недостаточная активность ряда ферментов: аденозиндезаминазы, пуриннуклеозидфосфорилазы, аденинфосфорибозилтрансферазы и т.д. [6; 8]. Врожденные, наследственные болезни обмена пуринов имеют широкий спектр клинических проявлений, которые включают анемию, иммунодефицит, камни в почках, судороги, задержку психического развития, аутизм и задержку роста. Генетические дефекты метаболизма интересны не только с биологической точки зрения, они могут иметь серьезные клинические проявления, в том числе такие как побочные реакции при лечении. Клиническая симптоматика наследственной патологии пуринового обмена широко варьирует по степени тяжести даже среди родственников из одной семьи. Наиболее часто при данном нарушении метаболизма страдают центральная нервная система, почки и система крови [8]. Причинами поражения почек может являться дефицит ксантиндегидрогеназы (ксантиноксидазы), аденинфосфорибозилтрансферазы, гиперактивность фосфорибозилдифосфатсинтазы I. Клиническая симптоматика обусловлена образованием в организме труднорастворимых соединений – мочевой кислоты, ксантина, 2,8-дигидроксиаденина, что проявляется мочекаменной болезнью. Имеются данные о существенных изменениях активности ферментов пуринового метаболизма при ревматоидном артрите. Активность включенных в исследование ферментов изменяется в зависимости от степени активности патологического процесса. Корреляционный анализ энзимных активностей свидетельствует о сложных функциональных взаимосвязях между ферментами пуринового метаболизма как в норме, так и при развитии патологического процесса. Изменение корреляционных зависимостей между активностями ферментов при развитии ревматоидного процесса свидетельствует об участии ферментных систем пуринового метаболизма в его патогенезе [9]. Еще одним примером может служить то, что дефицит гипоксантин/гуанинфосфорибозилтрансферазы (ГГФРТ) у многих пациентов приводит к увеличению в их клетках содержания ФРДФ [10] и к активации у них биосинтеза пуринов denovo [11].
Изучению патогенетических механизмов наследственных нарушений обмена пуринов придается особое значение, так как понимание этих механизмов во многом способствует разработке путей эффективного лечения и профилактики данных заболеваний [8]. Но нарушения метаболизма пуринов имеют важное значение и в развитии целого ряда ненаследственных заболеваний, особенно гипоксических, ишемических и терминальных состояний [12–14]. Согласно литературным данным, суммированным в работах [15–17], тканевые уровни различных метаболитов пуринового обмена и производные от них расчетные показатели на протяжении последних десятилетий предлагались в качестве индикаторов состояния энергетического обмена тканей при тяжелой гипоксической патологии.
Известно, что нарушения регуляции метаболических путей играют важную роль в патогенезе многих заболеваний [18–20]. Они, по сути, представляют собой нарушения способности биосистем к поддержанию нужного состояния, обеспечивающегося взаимодействием составных частей (подсистем) согласно определённым принципам. До сих пор остаются неизвестными некоторые механизмы регулирования биологических процессов, но при всем этом в созданном природой многообразии существуют универсальные способы поддержания состояния биосистем, в которых они могут нормально функционировать.
Двумя главными подсистемами метаболизма пуринов (пуриновой метаболической системы) являются адениновая и гуаниновая подсистемы. Промежуточным метаболитом между ними является инозинмонофосфат (ИМФ), который образуется в результате синтеза пуринов denovo, а также в результате реакции, катализируемой ГГФРТ. ИМФ может превращаться либо в аденилосукцинат, а затем в АМФ, либо в ксантозинмонофосфат (КМФ), а затем в ГМФ. В первом случае последовательно действуют ферменты аденилосукцинатсинтетаза и аденилосукцинатлиаза, во втором случае ИМФ-дегидрогеназа и ГМФ-синтетаза. АМФ и ГМФ далее превращаются в другие адениновые и гуаниновые производные. В биохимии к настоящему времени хорошо изучены механизмы, посредством которых регулируется отдельно взятая цепочка метаболических превращений, но гораздо менее изучено, каким образом скоординированы, сбалансированы между собой два параллельных метаболических пути, в данном случае адениновая и гуаниновая подсистемы.
Рассмотрим, какие регуляторные механизмы имеются в метаболизме пуринов.
1. Отрицательные обратные связи. Они хорошо известны в биокибернетике, патологической физиологии и биохимии, поэтому на них нет необходимости подробно останавливаться. Некоторые отрицательные обратные связи могут участвовать в обеспечении баланса адениновой и гуаниновой подсистем. Например, ФРДФ-синтетаза ингибируется как адениновыми, так и гуанировыми мононуклеотидами [2; 6]. В работе [21] суммированы литературные данные о том, что в молекуле амидофосфорибозилтрансферазы имеется два регуляторных участка – один для адениновых, другой для гуаниновых мононуклеотидов, причем в действии эффекторов наблюдается синергизм – совместное воздействие АМФ и ГМФ, АМФ и ГТФ, АДФ и ГТФ дает ингибирование, превышающее сумму их индивидуальных ингибирующих эффектов. В учебнике [2] даже утверждается, что ингибирование ФРДФ-синтетазы и амидофосфорибозилтрансферазы происходит лишь при одновременном повышении концентраций АМФ и ГМФ.
2. Перекрестные положительные обратные связи. Это особые связи, соединяющие выход первой подсистемы со входом второй, а выход второй подсистемы со входом первой. Это единственный на сегодняшний день известный в биохимии регуляторный механизм, называемый обычно реципрокным, функцией которого является регуляция отношений между двумя метаболическими подсистемами, в данном случае адениновой и гуаниновой. Суть его в следующем. Благодаря наличию реципрокных требований в отношении макроэрга возникает ситуация, когда для синтеза АМФ из ИМФ используется энергия ГТФ, а для синтеза ГМФ из ИМФ – энергия АТФ [2; 6]. Кроме того, согласно литературным данным, обобщенным в статье [21], АТФ ингибирует превращение (восстановительное дезаминирование) ГМФ в ИМФ, а ГТФ и, в меньшей мере, ГДФ ингибируют дезаминирование АМФ до ИМФ. Таким образом, АТФ стимулирует синтез гуаниновых мононуклеотидов, а ГТФ (и отчасти ГДФ) – синтез адениновых мононуклеотидов. Происходит взаимоподдержание, взаимоусиление двух подсистем метаболизма пуринов.
3. Отрицательные прямые связи. В общем виде отрицательная прямая связь может представлять собой отрицательное по знаку воздействие на итоговую активность фермента, реализующуюся in vivo, со стороны субстрата данного фермента или предшественника субстрата. Отрицательное по знаку воздействие может представлять собой ингибирование фермента, депрессию синтеза фермента, а также подавление превращения фермента из неактивной формы в активную или стимуляцию обратного процесса. В пуриновом обмене отрицательная прямая связь реализована как ингибирование аденилосукцинатсинтетазы избытком ИМФ. О наличии этого феномена свидетельствуют данные, обобщенные в работах [21; 22]. На основании этих данных можно полагать, что ингибирование аденилосукцинатлиазы наступает при менее выраженном избытке ИМФ, чем ингибирование аденилосукцинатсинтетазы, о чем свидетельствует индуцированное накопление аденилосукцината в головном мозге и скелетных мышцах крыс, у которых процесс увеличения содержания ИМФ запускался электрическим раздражением этих органов. При дальнейшем увеличении содержания ИМФ наступало ингибирование аденилосукцинатсинтетазы, поскольку накопление аденилосукцината в мозге и мышцах нивелировалось. В работе [21] суммированы литературные данные о том, что константа ингибирования (Ki) мышечной аденилосукцинатсинтетазы равна для ИМФ примерно 2 mM, что в десятки раз превышает внутриклеточную концентрацию данного метаболита в покоящейся мышце, однако 30-минутное изометрическое сокращение мышцы, вызванное электростимуляцией, приводит к увеличению внутриклеточной концентрации ИМФ до величин, в 2–3 раза превышающих Ki.
4. Перекрестный гомеостат метаболизма пуринов был постулирован авторами публикаций [21–23], основываясь на теоретических разработках одного из направлений кибернетики – гомеостатики. Существование в метаболизме пуринов перекрестного гомеостата подтверждается двумя независимыми друг от друга экспериментальными фактами, описанными в литературе. С одной стороны, известно, что для синтеза ГМФ из ИМФ используется энергия АТФ, и, кроме того, АТФ ингибирует превращение ГМФ в ИМФ (см. выше). Это означает, что с главного выхода адениновой подсистемы, которым является АТФ, на вход гуаниновой подсистемы идет положительная связь: чем выше уровень АТФ, тем больше образуется гуаниновых мононуклеотидов из ИМФ. С другой стороны, на аденилосукцинатсинтетазу оказывают ингибирующий эффект метаболиты, относящиеся к гуаниновой подсистеме: КМФ, ГМФ, циклический ГМФ, дезоксиГМФ, ГДФ, дезоксиГДФ и других гуаниновые мононуклеотиды. Эти наблюдения были получены на различных видах живых существ и обобщены в работах [4; 21; 24]. У позвоночных имеются кислый и основный изоферменты аденилосукцинатсинтетазы, причем их раздельное изучение показало, что гуаниновые производные (из них изучались только ГДФ и ГМФ) являются сильными ингибиторами обоих изоферментов аденилосукцинатсинтетазы [25].
Феномен ингибирования аденилосукцинатсинтетазы метаболитами гуаниновой подсистемы можно считать универсальным для всего живого, поскольку он был обнаружен у самых разных биологических объектов – от одноклеточных организмов до человека [4; 21; 24]. Однако попытки объяснить биологический смысл такого ингибирования исследователями, которые его обнаруживали, не предпринимались, хотя общебиологическая распространенность этого феномена должна была бы заставить задуматься о его сущности.
Известно, что ферменты способны иметь поразительно высокую специфичность в отношении субстратов и эффекторов [2; 6]. Поэтому маловероятно, что эволюция не смогла бы создать аденилосукцинатсинтетазу, нечувствительную к гуаниновым метаболитам. Скорее, речь может идти, наоборот, об эволюционном поддержании нужной степени неспецифичности данного фермента.
С точки зрения кибернетики ингибирование аденилосукцинатсинтетазы вышеперечисленными метаболитами гуаниновой подсистемы представляет собой перекрестную отрицательную обратную связь, идущую с выхода (точнее с нескольких выходов – по числу ингибиторов) гуаниновой подсистемы на вход адениновой подсистемы. В работе [21] приведены многочисленные литературные данные о том, что именно аденилосукцинатсинтетаза является ключевым регуляторным ферментом, лимитирующим синтез адениновых мононуклеотидов из ИМФ.
Поддержание устойчивости аденин-гуанинового перекрестного гомеостата осуществляется следующим образом. Чем больше в клетке синтезируется АТФ, тем сильнее становится стимулирующее влияние АТФ на синтез гуаниновых мононуклеотидов из ИМФ. Повышение содержания гуаниновых мононуклеотидов приводит к ингибированию синтеза АТФ из ИМФ, что уменьшает количество АТФ. Как следствие, тормозится синтез гуаниновых мононуклеотидов, поскольку АТФ служит источником энергии для их синтеза и ингибирует обратное превращение ГМФ в ИМФ. Можно полагать, что в квазистационарном состоянии эти колебательные процессы имеют небольшую амплитуду и высокую скорость. Совместное функционирование трех вышеописанных регуляторных механизмов обеспечивает сбалансированное, скоординированное протекание метаболизма адениновых и гуаниновых производных.
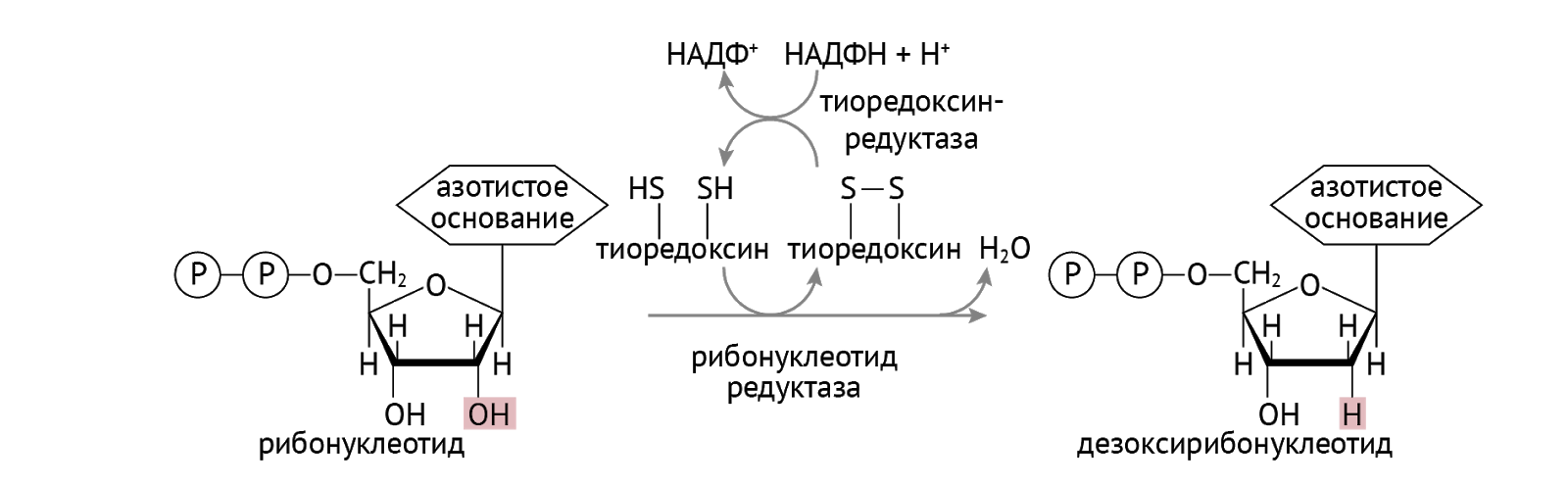
Дополнительным скоростьлимитирующим этапом при синтезе ДНК является образование дезоксирибонуклеотидов путем восстановления рибонуклеотидов [4; 6]. Согласно литературным экспериментальным данным, приведенным в статье [22], на этапе синтеза дезоксирибонуклеотидов взаимоотношения адениновой подсистемы с гуаниновой регулируются при помощи сходного перекрестного гомеостата: дезоксиГТФ активирует превращение АДФ в дезоксиАДФ, а дезоксиАТФ ингибирует превращение ГДФ в дезоксиГДФ; кроме того, гуанин стимулирует включение формиата (субстрат синтеза пуринов denovo) в аденин нуклеиновой кислоты, а аденин подавляет включение формиата в гуанин нуклеиновой кислоты.
Анализ литературы, проведенный в работах [21; 22], выявил широкую распространенность «перекрестного механизма» интеграции метаболических систем. Так, известно, что в синтезе пиримидинов у низших организмов ключевым ферментом является аспартаткарбомоилтрансфераза, а у высших – глутаминзависимая карбамоилфосфатсинтетаза. АТФ, который можно считать выходным метаболитом адениновой подсистемы и в целом пуриновой метаболической системы, стимулирует обе эти реакции. В свою очередь, метаболиты пиримидиновой метаболической системы (оротидинмонофосфат, уридинмонофосфат, уридиндифосфат, цитидинмонофосфат, цитидиндифосфат, тимидинмонофосфат, тимидиндифосфат, дезоксицитидинмонофосфат, дезоксицитидиндифосфат) ингибируют аденилосукцинатсинтетазу, являющуюся ключевым ферментом синтеза АТФ из ИМФ. Непосредственно в синтезе ДНК ключевым этапом является реакция восстановления рибонуклеотидов. Восстановленные пиримидиновые нуклеотиды (дезокситимидинтрифосфат, дезокситимидиндифосфат, дезоксиуридидинтрифосфат, дезокситимидинмонофосфат, дезоксицитидинтрифосфат) активируют восстановление пуриновых мононуклеотидов (ГДФ и АДФ), а дезоксиГТФ и дезоксиАТФ ингибируют восстановление цитидиндифосфата и уридиндифосфата [22].
Механизмы регуляции метаболизма пуринов изложены в настоящем обзоре лишь в словесной форме; наиболее сложный из них – перекрестный гомеостат, был описан в литературе также в виде метаболических и категориальных схем [21]. Представляется перспективным дальнейшее изучение нарушений указанных регуляторных механизмов в экспериментальных и клинических исследованиях на различных видах патологии, а также их математическое моделирование, например при помощи многофакторных регрессионных моделей [16; 26; 27]. Это позволит детально установить характер нарушений регуляции пуринового обмена при различных видах патологии.
Таким образом, с опорой на анализ и обобщение доступных литературных данных в обзоре рассмотрены 3 вида механизмов регуляции пуринового обмена, обеспечивающих его функционирование в различных нормально физиологических условиях: 1) отрицательные обратные связи, 2) перекрестные положительные обратные связи, 3) отрицательные прямые связи и 4) перекрестный гомеостат метаболизма пуринов. Они обеспечивают скоординированность и баланс двух основных подсистем метаболизма пуринов – адениновой и гуаниновой. Особый интерес представляет собой перекрестный гомеостат – в связи с его новизной не только для физиологии и биохимии, но и вообще для биокибернетики. Мы полагаем, что сбои в перечисленных механизмах регуляции имеют важное значение для возникновения и развития основных наследственных и ненаследственных нарушений метаболизма пуринов у человека.