Пузырьки при кипении воды что это
Из чего образуются пузыри при закипании воды?
Если вы когда-нибудь кипятили воду, то наверняка заметили, что при нагревании воды образуются очень маленькие пузырьки, которые поднимаются снизу вверх. Сначала пузырьки немногочисленны, но по мере нагревания воды начинает образовываться все больше пузырьков больших размеров. Дальнейшее повышение температуры приводит к появлению еще более крупных пузырьков, которые образуются довольно часто и сразу же поднимаются вверх. Эта эскалация достигает пика, когда вода начинает кипеть.
Но почему кипящая вода образует пузырьки?
Ответ на этот вопрос связан с химией самой воды. Точнее, это связано со всеми растворенными в воде веществами, а также с характером связи между молекулами воды.
Химические свойства молекул воды
Каждая молекула воды состоит из двух атомов водорода (H) и одного атома кислорода (O). Оба атома H ковалентно связаны с единственным атомом O. Каждый элемент в природе стремится достичь состояния с минимально возможной энергией. Это состояние достигается путем потери или приобретения электронов для достижения ближайшей конфигурации инертного газа.
Иллюстрация молекулы воды
Атом кислорода имеет шесть электронов в своей валентной (внешней) оболочке. Ближайший инертный газ, неон, имеет восемь электронов в своей валентной оболочке. Таким образом, O имеет сильную тенденцию получить два электрона и достичь стабильной электронной конфигурации (перейти в состояние с наименьшей энергией). Водород имеет один электрон в своей валентной оболочке, в то время как ближайший благородный газ, гелий, имеет два электрона на своей валентной оболочке. Таким образом, H стремится получить один электрон, чтобы достичь стабильной электронной конфигурации.
Оба атома H делят по одному электрону с O, а O делит два электрона, по одному на каждый H. Это ковалентная связь. Кислород имеет сильную тенденцию притягивать к себе общие электроны благодаря свойству, называемому электроотрицательностью. Таким образом, электроны проводят больше времени возле атома O, чем возле атома H, что приводит к частичному отрицательному заряду на O и частичному положительному заряду на H.
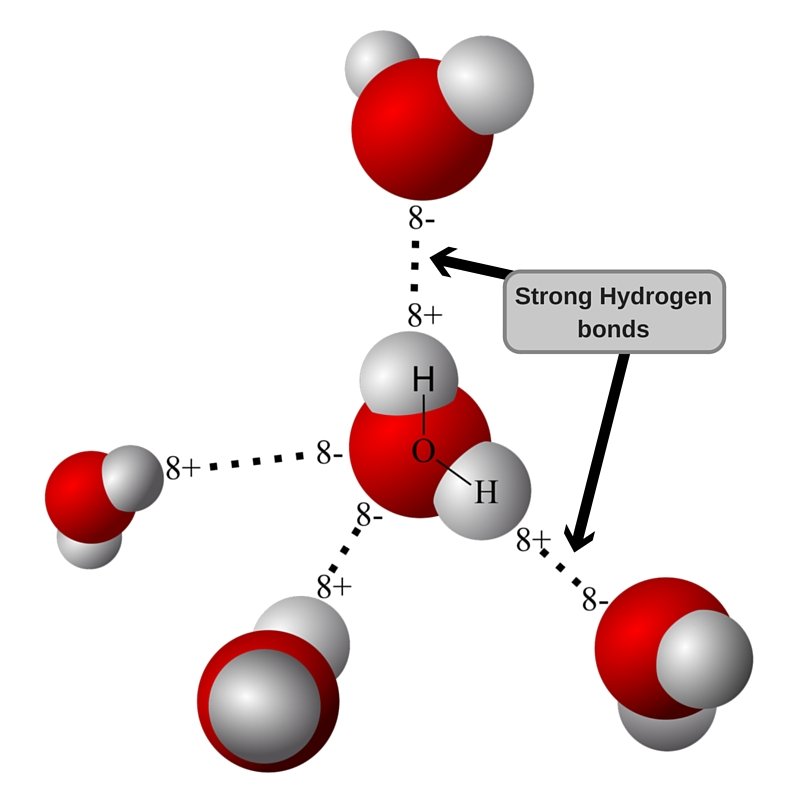
Геометрия молекулы воды такова, что заряды не компенсируются, и есть разделение центров заряда (поляризация). Когда две молекулы воды с небольшой поляризацией приближаются друг к другу, частично отрицательный O одной молекулы притягивает частично положительный H другой молекулы, образуя слабую межмолекулярную связь. Это называется водородной связью, и это сила, отвечающая за удержание молекул воды вместе.
Визуализация водородной связи.
Поскольку водородная связь слабая, вода остается жидкой при комнатной температуре, а при повышении температуры молекулы получают больше энергии для преодоления межмолекулярной водородной связи. При 100 °C энергии достаточно для того, чтобы молекулы вырвались на свободу.
Растворенные вещества в воде
Растворение одного вещества в другом возможно только при наличии взаимодействия между молекулами двух веществ. Подобным образом, некоторые газы, например, O2, CO2, N2, NH3 и SO2, растворяются в воде, потому что между молекулами воды и молекулами газа существует притягательное взаимодействие.
Есть два способа растворения газов в воде: ван-дер-ваальсова связь и водородная связь.
Гетероядерные молекулы (т.е. имеющие атомы из разных элементов), такие, как NH3 или CO2, имеют разницу в электроотрицательности между атомами. N и O более электроотрицательны, чем H и C, соответственно. Таким образом, N и O остаются частично отрицательными, а H и C становятся частично положительными. Это приводит к частичной поляризации молекул NH3 и CO2.
Отрицательные концы (N и O) притягиваются к частично положительному H воды; в то же время положительные концы (H и C) притягиваются к частично отрицательному O воды. Это и есть водородная связь. Чем больше поляризация газообразной молекулы, тем лучше она растворяется в воде.
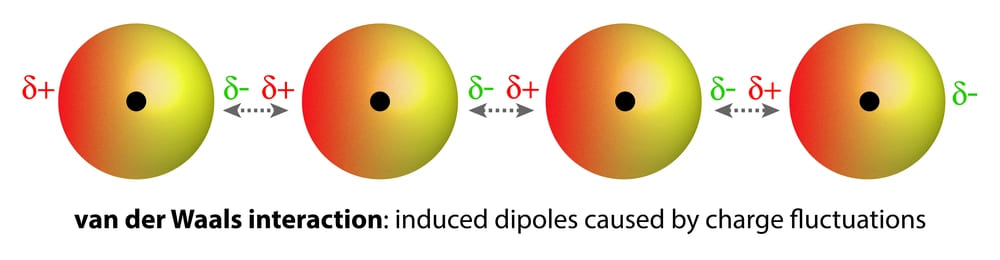
Гомоядерные молекулы (т.е. имеющие атомы одного и того же элемента), такие, как O2 и N2, неполярны и плохо растворимы (очень низкая растворимость) в воде. Слабые ван-дер-ваальсовы силы притяжения удерживают эти газы с молекулами воды. Они намного слабее, чем диполь-дипольные взаимодействия.
Слабые силы Ван-дер-Ваальса возникают из-за изменения распределения заряженных электронов вокруг атомов, что приводит к временной индуцированной поляризации.
Растворимость газов в воде уменьшается при повышении температуры.
Последовательность событий при кипении воды
Молекулы газа, вырывающиеся из воды.
Это бульканье продолжается до тех пор, пока не будет достигнута точка кипения воды. Нагревание воды происходит не совсем равномерно, то есть существуют области более высоких и более низких температур. При температуре выше 90 °С некоторые молекулы воды вблизи дна получают достаточно энергии для перехода в парообразную фазу. Образуются области газообразной воды, о чем свидетельствуют огромные пузыри, поднимающиеся со дна. Кроме того, из-за энергичного движения молекул конвективный нагрев еще больше повышает температуру. При температуре 100 °С почти все молекулы воды обладают достаточной кинетической энергией для перехода в парообразное состояние, и пузырьки водяного пара начинают стремительно подниматься вверх!
IT News
Last update Вс, 29 Янв 2017 11pm
Почему в кипящей воде образуются пузыри пара?
Любая жидкость при нагревании со временем достигает температуры, при которой она начинает кипеть. Во время кипения пузыри пара образуются во всем объеме жидкости, поднимаются на ее поверхность и лопаются, высвобождая горячий пар в воздух. Вода кипит при температуре 100°С (212°F).
При температуре кипения каждая молекула имеет достаточно энергии для преодоления сил, удерживающих ее вместе с другими молекулами в виде жидкости. Например, сосуд с кипящей водой содержит воду в жидком состоянии, которая превращается в водяной пар. Поверхностный водяной пар сразу же покидает кипящую воду. Что касается парообразования в толще воды, то там водяной пар формирует пузыри, каждый из которых, поднимаясь вверх, несет в себе миллиарды молекул воды.
Кипящая вода совершает фазовый переход из жидкого состояния в газообразное в процессе, называющемся парообразованием. Жидкости превращаются в пар и при температурах, меньших температуры кипения, в процессе, называющемся испарением. В отличие от кипения испарение происходит только с поверхности в том случае, когда молекулы имеют достаточно энергии, чтобы покинуть жидкость. Хотя испарение с ростом температуры интенсифицируется, пузыри пара образуются только во время кипения.
Рождение и гибель пузырей
Камень для предупреждения выплескивания
Используемые в лабораторной практике дистиллированная вода и другие чистые жидкости, будучи свободными от пыли, недодержат ядер парообразования. В таких жидкостях могут формироваться большие, похожие на пленку пузыри пара, приводящие к опасному выплескиванию кипящей жидкости из сосуда. Специальный пористый камень (снимок справа) предупреждает такое выплескивание, предоставляя свою поверхность для образования многочисленных, постепенно растущих пузырьков пара.
Пузырьки при кипении воды что это
«Кипе́ние — процесс интенсивного парообразования, который происходит в жидкости, как на свободной её поверхности, так и внутри её структуры. При этом в объёме жидкости возникают границы разделения фаз, то есть на стенках сосуда образуются пузырьки, которые содержат воздух и насыщенный пар.»
«По мере нагрева жидкости на греющей поверхности образуются пузырьки пара, внутрь которых испаряется жидкость. При определенной температуре давление насыщенного пара внутри пузырька становится равным наружному давлению. В этот момент пузырек отрывается от стенки, и жидкость начинает кипеть.»
При температуре кипения каждая молекула имеет достаточно энергии для преодоления сил, удерживающих ее вместе с другими молекулами в виде жидкости. Например, сосуд с кипящей водой содержит воду в жидком состоянии, которая превращается в водяной пар. Поверхностный водяной пар сразу же покидает кипящую воду. Что касается парообразования в толще воды, то там водяной пар формирует пузыри, каждый из которых, поднимаясь вверх, несет в себе миллиарды молекул воды.
Кипящая вода совершает фазовый переход из жидкого состояния в газообразное в процессе, называющемся парообразованием. Жидкости превращаются в пар и при температурах, меньших температуры кипения, в процессе, называющемся испарением. В отличие от кипения испарение происходит только с поверхности в том случае, когда молекулы имеют достаточно энергии, чтобы покинуть жидкость. Хотя испарение с ростом температуры интенсифицируется, пузыри пара образуются только во время кипения.
Молекулярная физика. Кипение жидкости.
Кипение — это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
В отличие от испарения, которое происходит при любой температуре жидкости, другой вид парообразования — кипение — возможен лишь при совершенно определенной (при данном давлении) температуре — температуре кипения.
При нагревании воды в открытом стеклянном сосуде можно увидеть, что по мере увеличения температуры стенки и дно сосуда покрываются мелкими пузырьками. Они образуются в результате расширения мельчайших пузырьков воздуха, которые существуют в углублениях и микротрещинах не полностью смачиваемых стенок сосуда.
Пары жидкости, которые находятся внутри пузырьков, являются насыщенными. С ростом температуры давление насыщенных паров возрастает, и пузырьки увеличиваются в размерах. С увеличением объема пузырьков растет и действующая на них выталкивающая (архимедова) сила. Под действием этой силы наиболее крупные пузырьки отрываются от стенок сосуда и поднимаются вверх. Если верхние слои воды еще не успели нагреться до 100 °С, то в такой (более холодной) воде часть водяного пара внутри пузырьков конденсируется и уходит в воду; пузырьки при этом сокращаются в размерах, и сила тяжести заставляет их снова опускаться вниз. Здесь они опять увеличиваются и вновь начинают всплывать вверх. Попеременное увеличение и уменьшение пузырьков внутри воды сопровождается возникновением в ней характерных звуковых волн: закипающая вода шумит.
Когда вся вода прогреется до 100 °С, поднявшиеся вверх пузырьки уже не сокращаются в размерах, а лопаются на поверхности воды, выбрасывая пар наружу. Возникает характерное бульканье — вода кипит.
Кипение начинается после того, как давление насыщенного пара внутри пузырьков сравнивается с давлением в окружающей жидкости.
Во время кипения температура жидкости и пара над ней не меняется. Она сохраняется неизменной до тех пор, пока вся жидкость не выкипит. Это происходит потому, что вся подводимая к жидкости энергия уходит на превращение ее в пар.
Температура, при которой кипит жидкость, называется температурой кипения.
Температура кипения зависит от давления, оказываемого на свободную поверхность жидкости. Это объясняется зависимостью давления насыщенного пара от температуры. Пузырек пара растет, пока давление насыщенного пара внутри него немного превосходит давление в жидкости, которое складывается из внешнего давления и гидростатического давления столба жидкости.
Чем больше внешнее давление, тем больше температура кипения.
Всем известно, что вода кипит при температуре 100 ºC. Но не следует забывать, что это справедливо лишь при нормальном атмосферном давлении (примерно 101 кПа). При увеличении давления температура кипения воды возрастает. Так, например, в кастрюлях-скороварках пищу варят под давлением около 200 кПа. Температура кипения воды при этом достигает 120°С. В воде такой температуры процесс варки происходит значительно быстрее, чем в обычном кипятке. Этим и объясняется название «скороварка».
И наоборот, уменьшая внешнее давление, мы тем самым понижаем температуру кипения. Например, в горных районах (на высоте 3 км, где давление составляет 70 кПа) вода кипит при температуре 90 °С. Поэтому жителям этих районов, использующим такой кипяток, требуется значительно больше времени для приготовления пищи, чем жителям равнин. А сварить в этом кипятке, например, куриное яйцо вообще невозможно, так как при температуре ниже 100 °С белок не сворачивается.
У каждой жидкости своя температура кипения, которая зависит от давления насыщенного пара. Чем выше давление насыщенного пара, тем ниже температура кипения соответствующей жидкости, т. к. при меньших температурах давление насыщенного пара становится равным атмосферному. Например, при температуре кипения 100 °С давление насыщенных паров воды равно 101 325 Па (760 мм рт. ст.), а паров ртути — всего лишь 117 Па (0,88 мм рт. ст.). Кипит ртуть при 357°С при нормальном давлении.
Теплота парообразования.
Теплота парообразования (теплота испарения) — количество теплоты, которое необходимо сообщить веществу (при постоянном давлении и постоянной температуре) для полного превращения жидкого вещества в пар.
Физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры, называется удельной теплотой парообразования.
Удельную теплоту парообразования обозначают буквой r и измеряют в джоулях на килограмм (Дж/кг).
Количество теплоты, необходимое для парообразования (или выделяющееся при конденсации). Чтобы вычислить количество теплоты Q, необходимое для превращения в пар жидкости любой массы, взятой при температуре кипения, нужно удельную теплоту парообразования r умножить на массу m:
При конденсации пара происходит выделение такого же количества теплоты:
Кипение
Содержание
Для того чтобы превратить жидкость в пар, существует два способа: испарение и кипение. В прошлых уроках мы подробно разобрали, как происходит процесс испарения. В его ходе образуется пар, который в зависимости от условий может быть насыщенным или ненасыщенным.
Явление кипения мы часто наблюдаем в повседневной жизни. Для того чтобы приготовить чай или кофе, сначала мы доводим воду до кипения. Чтобы сварить суп, мы ждем, когда закипит вода в кастрюле.
В данном уроке мы рассмотрим, как физика описывает этот процесс, изучим изменения, происходящие при кипении и установим зависимости от других величин.
Процесс кипения
Проведем опыт: будем нагревать воду в открытом стеклянном сосуде и измерять ее температуру.
Отметим, что до того, момента как мы начнем нагревать воду, с поверхности воды идет испарение. Пар при этом не виден глазу, но, тем не менее, существует.
Начнем нагревать воду. Мы заметим, что в воде начинают появляться пузырьки (рисунок 1, а). С повышением температуры они начинают увеличиваться в размерах.
В воде всегда растворено некоторое количество воздуха. При повышении температуры этот воздух выделяется из воды в виде пузырьков. Внутри них – воздух и водяной пар. Водяной пар там присутствует, потому что окружающая вода испаряется внутрь этих пузырьков воздуха.
Когда пузырьки поднимаются в верхние слои жидкости (более холодные), они уменьшаются в размерах. Происходит это из-за конденсации пара внутри пузырьков. Под действием силы тяжести они опускаются вниз в более горячую воду.
И снова начинают подниматься к поверхности. Происходит попеременное увеличение и уменьшение пузырьков, в ходе которых они двигаются в жидкости. При этом мы слышим шум. Он предшествует закипанию воды.
Кипение – это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
Температура кипения
Если испарение происходит при любой температуре, то кипение происходит при некоторой определенной температуре. При этом:
Температура кипения – это температура, при которой жидкость кипит.
Во время кипения температура жидкости не меняется.
Вспомните, при приготовлении того же супа после закипания воды огонь уменьшают. Теперь он просто поддерживает эту самую температуру кипения. Это дает экономию топлива.
Температура кипения зависит от давления на поверхность жидкости. Давление насыщенного пара в пузырьках при кипении всегда больше внешнего давления.
Соответственно, если мы увеличим внешнее давление, то температура кипения увеличивается. Если уменьшим – температура кипения тоже снизится.
Температура кипения некоторых веществ
В таблице 1 представлены экспериментально полученные значения температуры кипения для различных веществ.
| Вещество | $t_<кип>, \degree C$ | Вещество | $t_<кип>, \degree C$ |
| Водород | -253 | Вода | 100 |
| Кислород | -183 | Ртуть | 357 |
| Эфир | 35 | Свинец | 1740 |
| Спирт | 78 | Медь | 2567 |
| Молоко | 100 | Железо | 2750 |
Талица 1. Температура кипения некоторых веществ (при нормальном атмосферном давлении)
Графики кипения жидкостей
На рисунке видно, что горизонтальные участки графиков соответствуют процессам кипения. Они параллельны оси времени, температура на них остается постоянной. Чтобы определить, какой график соответствует каждой жидкости, нам нужно обратиться к таблице 1.
$70 \degree C$ – температура кипения спирта. Значит, 2 – график нагревания и кипения спирта.