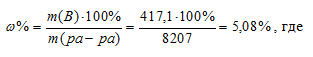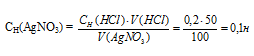Рассчитать молярную концентрацию раствора hno3 если известно что для приготовления 1000 см3
Решение задач по химии на расчет концентраций растворов веществ
Вычисление молярности и нормальности раствора
n(CuSO4) = (10 . 0,2)/1000 = 0,002 моль.
Находим сколько граммов CuSO4 содержится в 10 мл 0,2 М раствора, получим:
m(CuSO4) = n(CuSO4) . М(CuSO4) = 0,002 . 160 = 0,32 г.
Молярная масса эквивалента соли рассчитывается по формуле: Мэ = М(соли)/число атомов металла . валентность металла, получим:
Мэ(CuSO4) = М(CuSO4)/(1 . 2) = 160/2 = 80 г/моль.
Значит, Сн = [m(CuSO4) . 1000]/[Мэ(CuSO4) . 10] = (0,32 г . 1000 мл)/(80 г/моль . 10 мл) = 0,4 моль/л.
2) Для расчета молярности и нормальности раствора найдем массу фосфорной кислоты в 1 л (1000 мл) 5%-го раствора:
m(Н3РО4) = (w% . V . p)/100% = (5% . 1000 мл . 1,027 г/мл)/100% = 51,35 г.
Молярная масса эквивалента Н3РO4 равна 98/3 = 32,7 г/моль.
Задача на смешение растворов
m(р-ра)1 = 3000 . 1,054 г/см 3 = 3162 г;
m(р-ра)2 = 5000 . 1,009 г/см 3 = 5045 г;
Общая масса раствора, полученного после смешения:
Рассчитаем массу HNO3 в обоих растворах, получим:
m1 = [w%1 . m(р-ра)1]/100% = (10% . 3162)/100% = 316,2 г;
m2 = [w%2 * m(р-ра)2]/100% = (2 . 5045)/100% = г.100,9 г.
Определим массу HNO3 в полученном растворе после смешения, получим:
Рассчитаем процентную концентрацию, получим:
w%3 = (m3 . 100%)/m(р-ра)3 = (417,1 . 100%)/8207 = 5,08%.
Вычисление молярной, моляльной, нормальнои концентрации растворов
Решение задач по химии на выражение концентрации раствора
а) Молярная (мольно-объемная) концентрация показывает число молей растворенного вещества, содержащегося в1 л раствора. Масса 1 л раствора составляет 1000 . 1,178 = 1178 г. Массу хлорида кальция в литре раствора находим из соотношения:
Молярную концентрацию получим делением числа граммов Са Cl 2 в 1 л раствора на молярную массу Са Cl 2 (111,17 г/моль):
б) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса Са Cl 2 = М/2 = 111,17/2 = 55,585 г/моль, то
Ответ: 2,1М; 4,2 Н.
а) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора составляет1328 г (1000 . 1,328 = 1328 ). Массу NaOH в литре раствора находим из соотношения:
100 : 30 = 1328 : x ; x = (1328 . 3 0)/100 = 398,4 г.
Так как эквивалентная масса NaOH = М/1 = 40/1 = 40 г/моль, то
C н = 398,4/40 = 9,96 н.
б) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Масса раствора составляет 1328 + 5000 = 6328 г. Массовую (процентную) долю полученного раствора находим из соотношения:
6328 : 398,4 = 100 : х; х = (398,4 . 100)/6328 = 6,3%.
Ответ: 9,96 н.; 6,3%.
Ответ: 5,08%; 0,82 М.
100 : 20,8 = 1120 : x; x = (1120 . 20,8)/100 = 232,96 г.
а) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса HNO3 = М/1 = 63/1 = 63 г/моль, то
б) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу HNO3 в 1000 г растворителя находим из соотношения:
1000 : x = (1120 – 232,96) : 232/96; x = (1120 . 232,96)/ (1120 – 232,96) = 262,63 г.
100 : 16 = 1149 : x; x = (1149 . 16)/100 = 183,84 г.
Так как эквивалентная масса AlCl3 = М/3 = 133,6/3 = 44,5 г/моль, то
б) Молярная (мольно-объемная) концентрация показывает число молей растворенного вещества, содержащегося в 1 л раствора.
Молярную концентрацию получим делением числа граммов AlCl3 в 1 л раствора на молярную массу AlCl3 (133,6 г/моль):
CM = 183,84/133,6 = 1,38 M.
в) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу AlCl3 в 1000 г растворителя находим из соотношения:
1000 : x = (1149 – 183,84) : 183,84; x = (1149 . 183,84)/ (1149 – 183,84) = 190,48 г.
Cm = 190,48/133,6 = 1,43 M.
Ответ. 4,13 н.; 1,38М; 1,43 М.
Задание 146.
Сколько и какого вещества останется в избытке, если к 75 см 3 0,3 н. раствора Н2SO4 прибавить 125 см 3 0,2 н. раствора КОН? Ответ: 0,14 г КОН.
Решение:
Уравнение реакции имеет вид:
Вещества реагируют друг с другом в эквивалентных количествах, т.е. по уравнению реакции 2 эквивалента H2SO4 реагируют с 2-мя эквивалентами КОН. Находим количество эквивалентов H2SO4 в растворе из пропорции:
1000 : 0,3 = 75 : x; x = (75 . 0,3)/1000 = 0,0225 н.
1000 : 0,2 = 125 : x; x = (125 . 0,2)/1000 = 0,025 н.
Из расчетов количества эквивалентов видно, что количество эквивалентов КОН больше, чем H2SO4
(0,025 > 0,0225), значит, КОН взят в избытке. Находим количество избытка КОН: 0,025 – 0,0225 = 0,0025 н. Тогда масса избытка КОН равна:
Ответ: 0,14 г.
Задание 147.
Для осаждения в виде АgСI всего серебра, содержащегося в 100 см 3 раствора AgNO3, потребуется 50 см 3 0,2 н. раствора HCl. Какова молярная концентрация эквивалента раствора AgNO3? Какая масса АgСI выпала в осадок? Ответ: 0,1 н.; 1,433 г
Решение:
Уравнение реакции имеет вид:
AgNO3 + HCl = AgCl↓+ HNO3
Значит, объёмы реагирующих растворов обратно пропорциональны нормальности этих растворов. Исходя из этого, находим нормальность раствора AgNO3:
Количество AgCl равно количеству AgNO3 [n (AgCl) = n(AgNO3). Находим количество AgNO3 в 100 см 3 0,1Н его раствора из пропорции:
1000 : 01 = 100 : х; х = (100 . 0,1)/1000 = 0,01 Н или 0,01 М.
Отсюда находим массу AgCl:
m(AgCl) = n(AgCl) . M(AgCl) = 0,01 . 56,1 = 0,14 г.
m(KOH) = n(KOH) . M(KOH) = 0,0025 . 143,3 = 1,43 г.