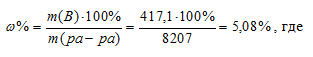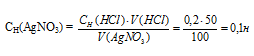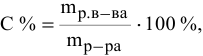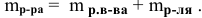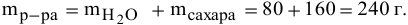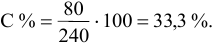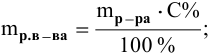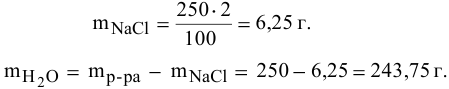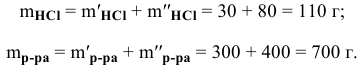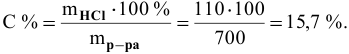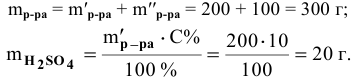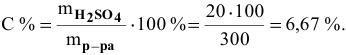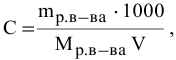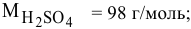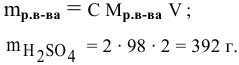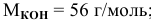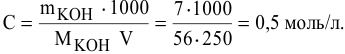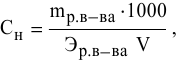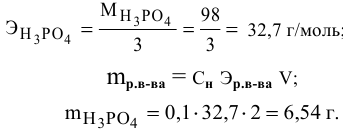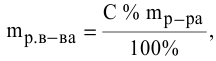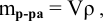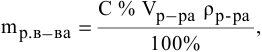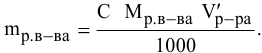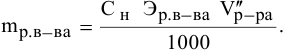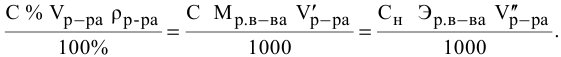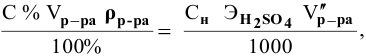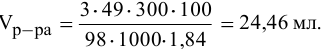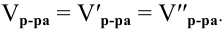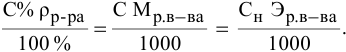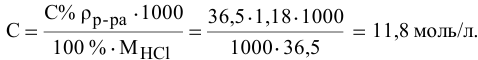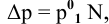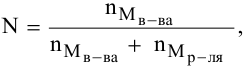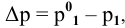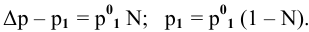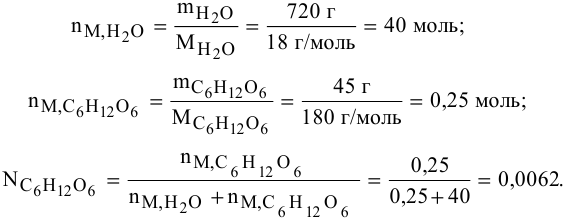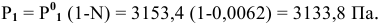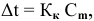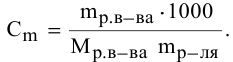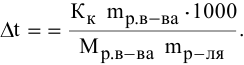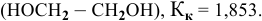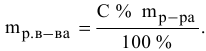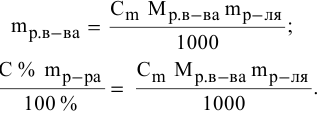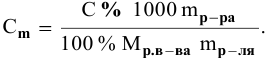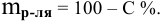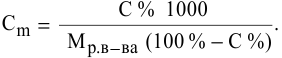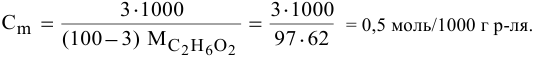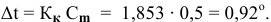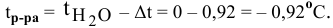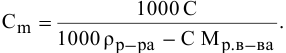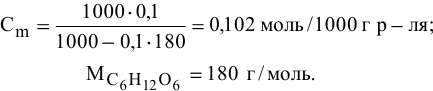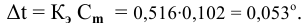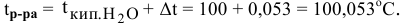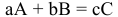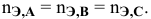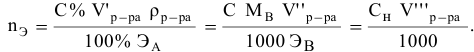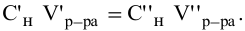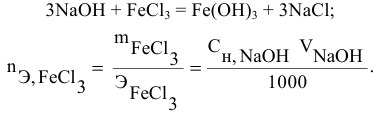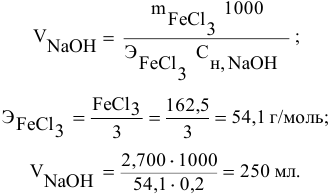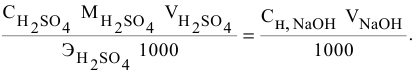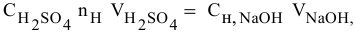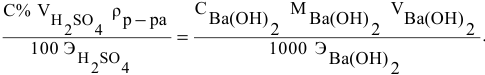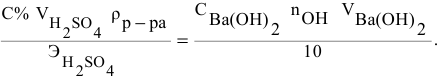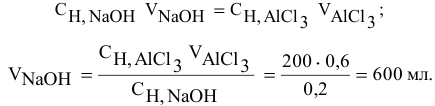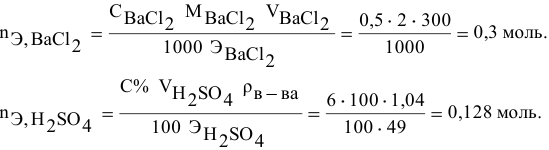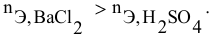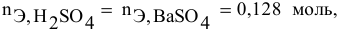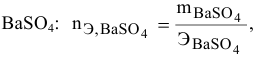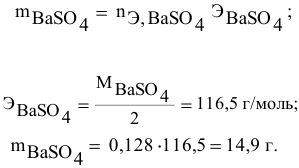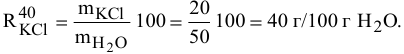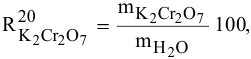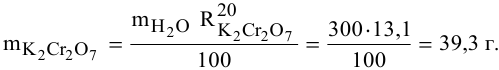Рассчитать молярную концентрацию раствора koh если известно что для приготовления 400 см3
Вычисление молярной, моляльной, нормальнои концентрации растворов
Решение задач по химии на выражение концентрации раствора
а) Молярная (мольно-объемная) концентрация показывает число молей растворенного вещества, содержащегося в1 л раствора. Масса 1 л раствора составляет 1000 . 1,178 = 1178 г. Массу хлорида кальция в литре раствора находим из соотношения:
Молярную концентрацию получим делением числа граммов Са Cl 2 в 1 л раствора на молярную массу Са Cl 2 (111,17 г/моль):
б) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса Са Cl 2 = М/2 = 111,17/2 = 55,585 г/моль, то
Ответ: 2,1М; 4,2 Н.
а) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора составляет1328 г (1000 . 1,328 = 1328 ). Массу NaOH в литре раствора находим из соотношения:
100 : 30 = 1328 : x ; x = (1328 . 3 0)/100 = 398,4 г.
Так как эквивалентная масса NaOH = М/1 = 40/1 = 40 г/моль, то
C н = 398,4/40 = 9,96 н.
б) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Масса раствора составляет 1328 + 5000 = 6328 г. Массовую (процентную) долю полученного раствора находим из соотношения:
6328 : 398,4 = 100 : х; х = (398,4 . 100)/6328 = 6,3%.
Ответ: 9,96 н.; 6,3%.
Ответ: 5,08%; 0,82 М.
100 : 20,8 = 1120 : x; x = (1120 . 20,8)/100 = 232,96 г.
а) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса HNO3 = М/1 = 63/1 = 63 г/моль, то
б) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу HNO3 в 1000 г растворителя находим из соотношения:
1000 : x = (1120 – 232,96) : 232/96; x = (1120 . 232,96)/ (1120 – 232,96) = 262,63 г.
100 : 16 = 1149 : x; x = (1149 . 16)/100 = 183,84 г.
Так как эквивалентная масса AlCl3 = М/3 = 133,6/3 = 44,5 г/моль, то
б) Молярная (мольно-объемная) концентрация показывает число молей растворенного вещества, содержащегося в 1 л раствора.
Молярную концентрацию получим делением числа граммов AlCl3 в 1 л раствора на молярную массу AlCl3 (133,6 г/моль):
CM = 183,84/133,6 = 1,38 M.
в) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу AlCl3 в 1000 г растворителя находим из соотношения:
1000 : x = (1149 – 183,84) : 183,84; x = (1149 . 183,84)/ (1149 – 183,84) = 190,48 г.
Cm = 190,48/133,6 = 1,43 M.
Ответ. 4,13 н.; 1,38М; 1,43 М.
Задание 146.
Сколько и какого вещества останется в избытке, если к 75 см 3 0,3 н. раствора Н2SO4 прибавить 125 см 3 0,2 н. раствора КОН? Ответ: 0,14 г КОН.
Решение:
Уравнение реакции имеет вид:
Вещества реагируют друг с другом в эквивалентных количествах, т.е. по уравнению реакции 2 эквивалента H2SO4 реагируют с 2-мя эквивалентами КОН. Находим количество эквивалентов H2SO4 в растворе из пропорции:
1000 : 0,3 = 75 : x; x = (75 . 0,3)/1000 = 0,0225 н.
1000 : 0,2 = 125 : x; x = (125 . 0,2)/1000 = 0,025 н.
Из расчетов количества эквивалентов видно, что количество эквивалентов КОН больше, чем H2SO4
(0,025 > 0,0225), значит, КОН взят в избытке. Находим количество избытка КОН: 0,025 – 0,0225 = 0,0025 н. Тогда масса избытка КОН равна:
Ответ: 0,14 г.
Задание 147.
Для осаждения в виде АgСI всего серебра, содержащегося в 100 см 3 раствора AgNO3, потребуется 50 см 3 0,2 н. раствора HCl. Какова молярная концентрация эквивалента раствора AgNO3? Какая масса АgСI выпала в осадок? Ответ: 0,1 н.; 1,433 г
Решение:
Уравнение реакции имеет вид:
AgNO3 + HCl = AgCl↓+ HNO3
Значит, объёмы реагирующих растворов обратно пропорциональны нормальности этих растворов. Исходя из этого, находим нормальность раствора AgNO3:
Количество AgCl равно количеству AgNO3 [n (AgCl) = n(AgNO3). Находим количество AgNO3 в 100 см 3 0,1Н его раствора из пропорции:
1000 : 01 = 100 : х; х = (100 . 0,1)/1000 = 0,01 Н или 0,01 М.
Отсюда находим массу AgCl:
m(AgCl) = n(AgCl) . M(AgCl) = 0,01 . 56,1 = 0,14 г.
m(KOH) = n(KOH) . M(KOH) = 0,0025 . 143,3 = 1,43 г.
Задачи с решениями на концентрацию растворов
Концентрация растворов. Растворы неэлектролитов. Растворимость
Задача:
Расчеты по процентной концентрации растворов. Формула, выражающая процентную концентрацию раствора —
где 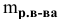
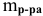
Задача:
Рассчитать процентную концентрацию раствора, полученного растворением 80 г сахара в 160 г воды.
Решение:
Задача:
Рассчитать массы поваренной соли и воды, необходимые для приготовления 250 г 2,5%-ного раствора.
Решение:
Задача:
Рассчитать концентрацию раствора, полученного смешением З00 г 10%-ного раствора хлороводорода и 400г 20%-ного раствора хлороводорода.
Решение:
Определяем массы растворенной 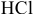
Определяем концентрацию полученного раствора:
Задача:
Какова концентрация серной кислоты в растворе, полученном смешиванием 200г 10%-ного раствора серной кислоты и 100г 5%-ного раствора сульфата натрия?
Решение:
Масса полученного раствора определяется как сумма масс смешанных растворов:
Далее определим концентрацию серной кислоты в полученном растворе:
Задача:
Расчеты по молярной концентрации (молярности) раствора.
Формула для расчета молярности раствора —
где С — молярность раствора, моль/л;
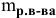
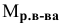
V — объем раствора, мл; если объем выражается в литрах, тогда в формуле исчезает коэффициент 1000.
Задача:
Какая масса серной кислоты необходима для приготовления 2 л 2-молярного раствора?
Решение:
Задача:
250 мл раствора содержат 7г КОН. Какова молярность этого раствора?
Решение:
Задача:
Расчеты по нормальной концентрации (нормальности) раствора.
Для расчета нормальности пользуемся следующей формулой:
где 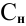
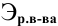
Задача:
Какая масса фосфорной кислоты необходима для приготовления 2 л 0,1 н раствора?
Решение:
Задача:
Расчеты по разбавлению растворов.
Выведем формулу для расчетов при разбавлении растворов, учитывая, что концентрация как исходного, так и приготовленного растворов может быть выражена любым способом 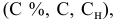
Для раствора, концентрация которого выражена в процентах,
а так как
где 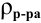
Для молярной концентрации
Для нормальной концентрации
Приравниваем правые части уравнений:
Задача:
Сколько миллилитров 98%-ного раствора серной кислоты
( 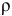
Решение:
Воспользуемся первым членом приведенного выше уравнения для концентрированного исходного раствора кислоты и третьим членом — для приготовления разбавленного раствора серной кислоты:
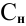
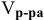
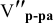
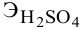
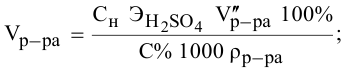
Задача:
Расчеты по переходу от одного способа выражения концентрации данного раствора к другому.
При переходе от одной концентрации данного раствора к другой остаются постоянными не только масса растворенного вещества, но и объем раствора, т.е.
Предыдущая формула принимает следующий вид:
Задача:
Определить молярность 36,5%-ного раствора соляной кислоты (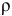
Решение:
Воспользуется первым и вторым членами последнего уравнения и выведем выражение для определения молярности:
Задача:
Расчеты по законам Рауля. Давление паров разбавленного раствора.
По закону Рауля, понижение давления пара 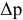
где 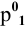
N — мольная доля растворенного вещества,
где 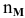
где 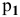
Задача:
Определить давление насыщенных паров раствора, содержащего 45 г глюкозы 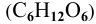
Решение:
Рассчитываем мольную долю растворенного вещества:
Определяем давление паров воды над раствором:
Задача:
Расчеты по понижению температуры замерзания растворов.
По закону Рауля понижение температуры замерзания прямо пропорционально моляльной концентрации раствора:
где 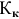
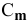
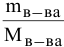
Задача:
Рассчитать температуру замерзания 3%-ного водного раствора этиленгликоля
Решение:
Выведем формулу для перехода от процентной концентрации к моляльности раствора.
Для процентной концентрации
Если принять 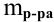
Находим моляльность рассматриваемого раствора:
Рассчитаем понижение температуры замерзания раствора:
Температура замерзания водного раствора
Задача:
Рассчитать температуру кипения 0,1 молярного водного раствора глюкозы ( 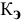
Решение:
Формула для перехода от молярной концентрации к моляльной —
Так как раствор разбавленный, то принимаем 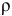
Определяем повышение температуры кипения раствора:
Температура кипения этого раствора
Задача:
Расчеты по уравнению химической реакции, протекающей в растворе.
Для химического уравнения общего вида
верно следующее соотношение числа эквивалентов:
Если участвующие в реакции вещества взяты в виде растворов и если их концентрации выражены:
а) для вещества А — С %;
б) для вещества В — С (молярность);
в) для вещества С — 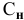
тогда массы и число эквивалентов каждого из веществ, находящихся в определенных объемах растворов этих веществ, определяются по формулам:
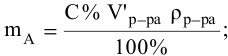
Так как числа эквивалентов, участвующих в реакции веществ, равны между собой, то можно записать:
Если концентрации участвующих в реакции веществ выражены в нормальности, то формула для расчетов приобретает вид:
Задача:
Какой объем 0,2 н раствора щелочи необходим для осаждения 2,708 г хлорида трехвалентного железа в виде гидроксида железа?
Решение:
Предложенный метод не требует обязательного написания уравнения реакции для осуществления таких расчетов.
Задача:
Решение:
Формула для расчета —
Так как 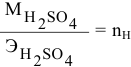
Задача:
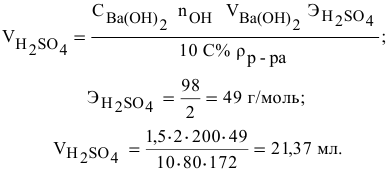
Какой объем 80 %-ного раствора 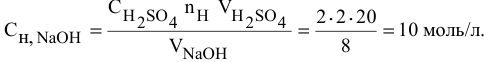
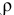
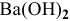
Решение:
Формула для расчета —
Так как 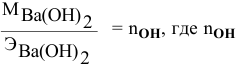
Задача:
Какой объем 0,2 н раствора щелочи необходим для реакции осаждения 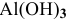
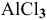
Решение:
Формула для расчета —
Задача:
Смешивается 300 мл 0,5 М раствора хлорида бария со 100 мл 6 %-ного раствора серной кислоты ( 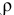
Решение:
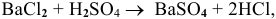
Так как указаны количества обоих реагирующих веществ, то необходимо определить вещество, взятое в избытке.
Таким образом, 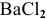
Дальнейший расчет производим по веществу, взятому в недостатке, т.е. по серной кислоте.
Так как
находим массу
Задача:
Для приготовления насыщенного раствора К.С1 при 40°С взято 50г воды и 20г КС1. Какова растворимость К.С1 в воде при данной температуре?
Решение:
Задача:
В 300г горячей воды растворено 219г 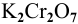
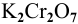
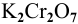
Решение:
Определяем, сколько может быть растворено 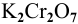
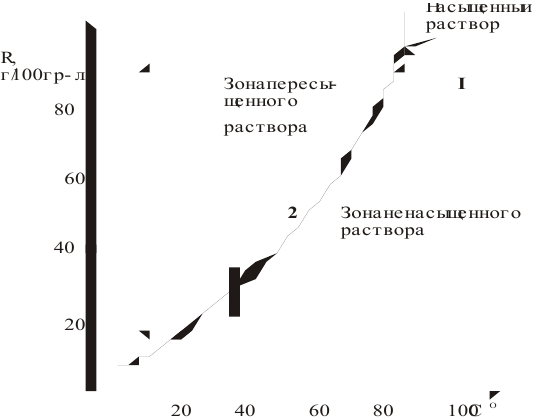
Масса кристаллов — это разность массы растворенного вещества в горячем растворе и массы растворенного вещества в охлажденном растворе (рис.З):
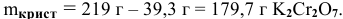
Рис. 3 — Графическое изображение процесса выпадения кристаллов при охлаждении раствора:
1 — участок охлаждения ненасыщенного раствора от заданной температуры до температуры образования насыщенного раствора;
2 — участок охлаждения насыщенного раствора до заданной температуры с уменьшением растворимости вещества, что приводит к его кристаллизации (в данном случае мы предполагаем, что пересыщенный раствор не образуется).
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института