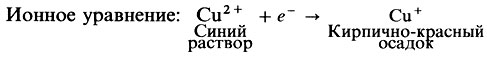Редуцирующие и нередуцирующие сахара что это
Редуцирующие и нередуцирующие сахара что это
5.2.2. Дисахариды
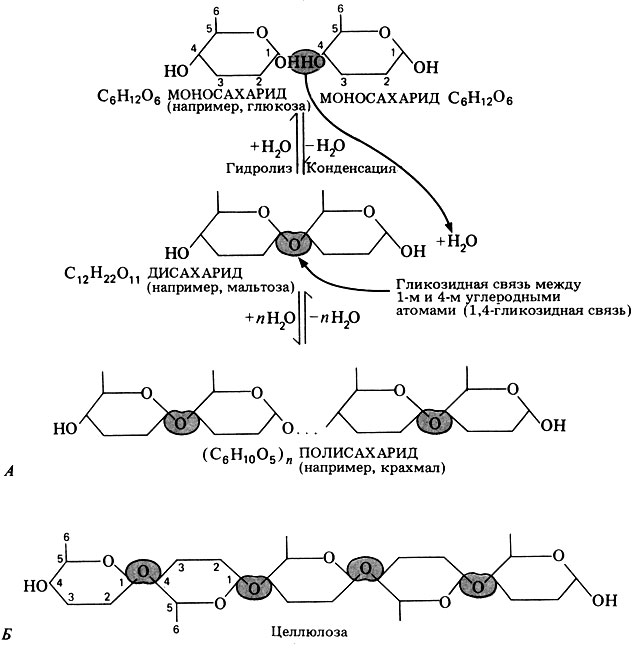
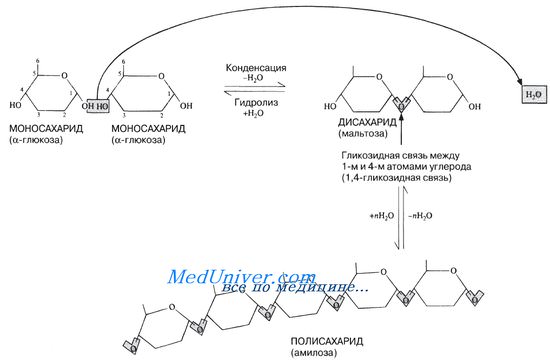
На рис. 5.6 отмечены некоторые свойства дисахаридов. Дисахариды образуются в результате реакции конденсации между двумя моносахаридами, обычно гексозами (рис. 5.14).
Рис. 5.14. А Образование дисахарида и полисахарида. Показаны лишь те части молекул, которые в данном случае представляют для нас интерес. Полностью молекула глюкозы представлена на рис. 5.13. Б. Строение целлюлозы. У некоторых полисахаридов, например у целлюлозы, присоединяемые моносахаридные единицы при каждой очередной конденсации поворачиваются на 180°
Связь между двумя моносахаридами называют гликозидной связью. Обычно она образуется между 1-м и 4-м углеродными атомами соседних моносахаридных единиц (1,4-гликозидная связь). Этот процесс может повторяться бессчетное число раз, в результате чего и возникают гигантские молекулы полисахаридов (рис. 5.14). После того как моносахаридные единицы соединятся друг с другом, их называют остатками. Таким образом, мальтоза состоит из двух остатков глюкозы.
Среди дисахаридов наиболее широко распространены мальтоза, лактоза и сахароза:
Мальтоза образуется из крахмала в процессе его переваривания (например, в организме животных или при прорастании семян) под действием ферментов, называемых амилазами. Расщепление мальтозы до глюкозы происходит под действием фермента, называемого мальтозой. Лактоза, или молочный сахар, содержится только в молоке. Сахароза, или тростниковый сахар, наиболее распространена в растениях. Здесь она в больших количествах транспортируется по флоэме. Иногда она откладывается в качестве запасного питательного вещества, так как метаболически она довольно инертна. Промышленным способом сахарозу получают из сахарного тростника или из сахарной свеклы; именно она и есть тот самый «сахар», который мы обычно покупаем в магазине.
Редуцирующие сахара
Лекция на тему «Углеводы»
Тема: Редуцирующие и нередуцирующие сахара
Моносахариды и большинство дисахаридов обладают редуцирующей способностью, все они обязаны (альдегидной) карбоксильной группе, которую они имеют в своей же молекуле. Свободный конец атома используется путем передачи электонов другой свободной молекуле. Их открытая химическая структура (с двумя кольцами химических веществ) позволяет им разбиваться с удвоенной скоростью дисахаридов.
Этот редуцирующий характер можно продемонстрировать с помощью окислительно-восстановительной реакции, проводимой между ними и сульфатом меди (II). Растворы этой соли имеют синий цвет. После реакции с восстановительным углеводным оксидом меди (I) образуется кирпично-красный цвет. Таким образом, изменение цвета указывает на то, что указанная реакция произошла и что, следовательно, данный углевод редуцирующий. Ученые используют несколько обычных химических составов на определение редуцирующего сахара: самые распространенные реакция Бенедикта и реакция Фелинга.
Сахара, которые дают положительные результаты по тестам известны как редуцирующие сахара. Положительный результат дают сахара с полуацетальную или гемикетальную группой. Но я не буду их рассматривать(это для общего понятия).
Самыми распространенными сахарами в продуктах питания являются глюкоза и фруктоза (моносахариды), а в меньшей степени лактоза и галактоза(дисахариды). Ряд сахаров или сахароза не является редуцирующим сахаром, но если сахарный раствор нагревается или подкисляется, идет гидролиз: сахароза разрушается до глюкозы и фруктозы, а это уже моносахариды. И они редуцируются.
Это углеводы – полисахариды. Самая распространенная – сахароза. Имеет закрытую (замкнутую )химическую структуру. У нее несколько химических колец(три), где открытые атомы используются для связывания структуры в целом и, следовательно, не имеют свободных электронов для отдачи связующей молекуле. Из-за этого окисления нет во время реакции. Чтобы вызвать разложение, понадобится гораздо больше времени.
У нередуцирующего сахара нет реакционной способности, нет альдегидной группы, поэтому тест Бенедикта дает отрицательный результат.

2. Раствор фруктозы + 2 капли реактива Бенедикта
3. Раствор глюкозы + 2 капли реактива Бенедикта
4. Раствор лактозы + 2 капли реактива Бенедикта
Редуцирующие и нередуцирующие сахара что это
Лактоза, или молочный сахар, содержится только в молоке и служит важным источником энергии для детенышей млекопитающих. Она переваривается медленно и потому способна обеспечивать постоянный стабильный приток энергии.
Сахароза, или тростниковый сахар — самый распространенный в природе полисахарид. Чаще всего она встречается в растениях, где в больших количествах транспортируется по флоэме. Сахароза особенно пригодна для этого, так как благодаря ее высокой растворимости она может транспортироваться в виде весьма концентрированных растворов.
В химическом отношении сахароза довольно инертна, т. е. при перемещении из одного места в другое она практически не вовлекается в метаболизм. По этой же причине сахароза иногда откладывается в качестве запасного питательного вещества. Промышленным способом сахарозу получают из сахарного тростника или сахарной свеклы; именно она и есть тот самый «сахар»,который мы обычно покупаем в магазине.
Редуцирующие сахара
Все моносахариды и некоторые дисахариды, в том числе мальтоза и лактоза, относятся к группе редуцирующих (восстанавливающих).
Сахаров, т. е. соединений, способных вступать в реакцию восстановления. Сахароза представляет собой единственный нередуцирующий сахар среди распространенных Сахаров. Две обычные реакции на редуцирующие сахара — реакция Бенедикта и реакция Фелинга — основаны на способности этих Сахаров восстанавливать ион двухвалентной меди до одновалентной. В обеих реакциях используется щелочной раствор сульфата меди(II) (CuSO4), который восстанавливается до нерастворимого оксида меди(1) (Cu20).
Сахара и сиропы.
| Таблица 10.1. Типичные химические параметры кристаллического белого сахара |
Поляризация 99,8 мин
Инвертный сахар 0,30% макс
Медь 1,0 частейна миллион(ррт)
Свинец 0,5 частейна миллион(ррт)
Мышьяк 1,0 частейна миллион(ррт )
| Типичные характеристики размера частиц: | |
| крупные гранулированные МА = 940-1000 мкм | CV = 20-30%; |
| гранулированные МА = 570-635 мкм | CV = 26 — 30%; |
| пудра МА = 276-300 мкм | CV= 16-26%. |
Разброс размеров частиц сахарного песка, поступающего с различных рафинадных заводов, может быть очень большим; можно ожидать МЛ от 475 до 670 мкм.
На рис. 10.1 это соотношение представлено графически.
Нанесите эти значения на логарифмическую бумагу, как показано на рис. 10.2. Фактически получается четыре графика нормального распределения в виде четырех прямых линий. Условия на сахар указывают, что проба будет находиться в области, ограниченной этими четырьмя линиями. Типичная проба может иметь следующие результаты просеивания:

10.2.1.2. Транспортировка и хранение сахарного песка
10.2.2.1. Измерение концентрации сахара в растворе.
вать медом синтетический мед, и для определения фальсификации могут быть использованы соответствующие аналитические методы.
| Примечание: дополнительная информация по искусственным подсластителям приведена в гл. 17. |
10.4.1. Декстрозная эквивалентность
| Таблица 10.5. Типичные характеристики двух традиционно применяемых сиропов глюкозы |
таблицы, связывающие градусы Боме с содержанием СВ при различных значениях ДЭ. Широко доступны сиропы со значениями 42/43 °Ве, то есть около 81% СВ. Эти сиропы при температуре 40 °С имеют вязкость, приемлемую для большинства применений.
Сухая кристаллическая фруктоза на 73% слаще сахарозы. Она относительно дорога, но является безопасным и приемлемым подсластителем для диабетиков. Фруктоза полезна в начинках для печенья, но не дает такой текстуры, которую дает сахароза в готовом печенье.
10.6. Реакция Майяра
| Таблица 10.7. Относительная степень сладости различных сахарных спиртов(полиолов) |
Подслащивающая способность и калорийность у всех полиолов ниже, чем у сахарозы, в связи с чем их часто применяют в продуктах с пониженной калорийностью, включая шоколад. Сорбит и ксилитол встречаются в натуральном виде во фруктах и ягодах. Наряду с другими полиолами они являются подсластителями, пригодными для диабетиков, у которых существуют затруднения с усвоением сахарозы и других сахаров из-за подъема содержания в крови глюкозы (см. раздел 30.4.4). Полидекстроза используется как несладкий наполнитель, пригодный для диабетиков.
Редуцирующие сахара
Отработка методики количественного определения редуцирующих сахаров в рабочем растворе. Установление соответствия нормальным содержаниям редуцирующих сахаров в кондитерских изделиях, содержащихся в ГОСТе, формирование их потребительских свойств.
Сахар. Редуцирующие сахара
Значение сахаров для организма
Методы определения сахара в кондитерских изделиях
Приготовление медного щелочно-цитратного раствора(реактива Бенедикта)
Обсуждение результатов исследования
1. Определение содержания редуцирующих сахаров в мармеладе
2. Определение содержания редуцирующих сахаров в пастиле
3. Определение содержания редуцирующих сахаров в карамели
Йодометрией называют метод объемного анализа, в ос-нове которого лежат реакции:
Методом йодиметрии можно определять как окисли-тели, так и восстановители.
Определение окислителей. Методом йодиметрии можно определять те окислители, которые количественно окисляют IЇ в свободный I2. Чаще всего определяют перманганаты, бихроматы, соли меди (II), соли желе-за (III), свободные галогены и др. Индикатором в методе йодиметрии служит раствор крахмала. Это чувствительный и специфический инди-катор, образующий с йодом адсорбционное соединение синего цвета.
Отработка методики количественного определения редуцирующих сахаров в рабочем растворе.
Установить соответствие нормальным содержаниям редуцирующих сахаров в кондитерских изделиях содержащихся в ГОСТ
Основным сырьем для производства кондитерских товаров служат сахар, инвертный сироп, мука, жиры, молоко. Кроме того, при производстве кондитерских изделий используются фрукты и ягоды, орехи, какао-бобы, мед, пряности также многие другие продукты.
В формировании потребительских свойств кондитерских изделий большая роль придается продуктам, которые придают им структуру, внешний вид, вкус и цвет: студнеобразователям, эмульгаторам, пенообразователям, красителям, ароматизаторам.
редуцирующий сахар кондитерский потребительский
Сахар. Редуцирующие сахара
Инвертный сироп служит заменителем патоки, так как обладает антикристаллизационными свойствами. Получают инвертный сироп нагреванием водного раствора сахара с кислотой, при этом происходит процесс инверсии, заключающийся в расщеплении сахарозы на фруктозу и глюкозу. Для инверсии используются кислоты: соляная, лимонная, молочная, уксусная.
Все моносахариды, в случае с сиропом глюкоза и фруктоза, и некоторые дисахариды, в том числе мальтоза и лактоза, относятся к группе редуцирующих (восстанавливающих) сахаров, т. е. соединений, способных вступать в реакцию восстановления.
Реакция Фелинга наиболее часто используется для доказательства восстанавливающих свойств сахаров, она заключается в восстановлении моносахаридами гидроксида меди (II) в закись меди (I). При проведении реакции используется реактив Фелинга, представляющий собой смесь сульфата меди с сегнетовой солью (калий, натрий виннокислый) в щелочной среде. При смешивании сульфата меди со щелочью образуется гидроксид меди.
В присутствии сегнетовой соли выделившийся гидроксид не выпадает осадок, а образует растворимое комплексное соединение меди (II), которое восстанавливается в присутствии моносахаридов с образованием закисной меди (I). При этом альдегидная или кетон- группа моносахарида окисляется до карбоксильной группы. Например, реакция глюкозы с реактивом Фелинга.
Значение сахаров для организма
Фруктоза менее распространена, чем глюкоза, и также быстро окисляется. Часть фруктозы в печени превращается в глюкозу, но для своего усвоения она не требует инсулина. Этим обстоятельством, а также значительно более медленным всасыванием фруктозы сравнительно с глюкозой в кишечнике, объясняется лучшая переносимость ее больными сахарным диабетом.
Методы определения сахара в кондитерских изделиях
Поскольку контроль содержания уровня сахара в организме необходим, существует целый ряд различных методов определения количества как общих, так и редуцирующих (инверсных) сахаров в кондитерских изделиях,
что является важной частью контроля качества производства данной продукции.
Метод основан на восстановлении щелочного раствора меди некоторым количеством раствора редуцирующих сахаров и определении количества образовавшегося оксида меди (1) или невосстановившейся меди йодометрическим способом.
Метод применяется для всех видов кондитерских изделий и полуфабрикатов, кроме мучных кондитерских изделий, полуфабрикатов для тортов и пирожных и восточных сладостей.
Метод применяется при возникновении разногласий в оценке качества.
Метод основан на восстановлении соли железа (III) оксидом меди (I) и последующем титрова-нии восстановленного оксида железа (И) перманганатом.
Метод основан на измерении вращения плоскости поляризации света оптически активными ве-ществами.
Метод применяется для определения массовой доли общего сахара в шоколаде, пралине, какао- напитках, шоколадных пастах, сладких плитках, шоколадных полуфабрикатах без добавлений и с добавлением молока.
Приготовление и стандартизация раствора С(Na2S2O3)=0,1 моль/дм3
1. Мерная колба 100см3;
2. Мерный цилиндр вместимостью 25см3;
3. Коническая колба для титрования 250 см3
4. Бюретка на 25 мл
Рабочий раствор тиосульфата натрия готовят по навеске, исходя из заданной концентрации раствора и его объема. Для приготовления 200 мл 0,1 м раствора тиосульфата натрия отвешивают в бюксе на технических весах 5 г тиосульфата натрия. Взятую навеску растворяют в 200 мл дистиллированной воды и добавляют 0,02 г соды. Раствор хранят в склянке из темного стекла.
Определение точной концентрации раствора тиосульфата натрия проводится по 2—3 точным навескам дихромата калия полумикрометодом (бюретка объемом 25 мл, цена деления 0,1 мл). Навеску дихромата калия рассчитывают с учетом объема мерной колбы, пипетки, бюретки и концентрации приготовленного раствора тиосульфата натрия. Учитывая, что на титрование аликвоты раствора дихромата калия должно пойти 10 мл 0,1 М тио сульфата натрия и соотношение объема мерной колбы и пипетки
100 : 10, рассчитываем массу дихромата калия:
m(K2Cr2O7) = C(Na2S2O3) ЧV(Na2S2O3) ЧМ(1/6 K2Cr2O7) Ч100/10 = 0,1Ч 10 49Ч10 = 490 мг = 0,49 г.
Точная навеска дихромата калия лежит в пределах 0,47—0,51 г.Пробирку с дихроматом калия взвешивают на аналитических весах, отсыпают дихромат через воронку в мерную колбу на 100 мл и взвешивают пробирку с дихроматом калия. По разности взвешиваний находят навеску дихромата калия. Дистиллированной водой смывают дихромат калия с воронки в колбу, взбалтывают со держимое колбы до полного растворения дихромата калия
и только после этого доливают воду до метки. Раствор хорошо перемешивают. Пипетку на 10 мл промывают раствором дихромата калия
и отбирают 1/10 часть его в колбу для титрования объемом на 250 мл, добавляют 5 мл 10 % раствора KI и 5 мл 2 М раствора HCl. Колбу закрывают часовым стеклом и оставляют на 5 мин в темном месте. Затем к раствору добавляют 50 мл воды и титруют раствором тиосульфата натрия, добавляя его по каплям и хорошо перемешивая раствор. Когда окраска раствора из бурой перейдет в бледно-желтую, добавляют 50 капель раствора крахмала
(2—3 мл) и продолжают титрование до перехода синей окраски раствора в бледно-зеленую, почти бесцветную. При втором и последующих титрованиях крахмал добавляется возможно ближе к концу титрования. Отсчет объема раствора тиосульфата натрия ведется с точностью до ±0,005 мл. Титрование аликвотной части раствора дихромата калия проводят 3—4 раза и вычисляют среднее значение объема тиосульфата натрия (Vср.), относительное отклонение от среднего не более 0,5 %. По экспериментальным данным рассчитывают титр тиосульфата натрия по дихромату калия.
М(1/6 K2Cr2O7)=49 г/моль
М(Na2S2O3Ч 5pO)=248 г/моль
M (Na2S2O3)=158,11 г/мл
m(K2Cr2O7)= C(Na2S2O3) Ч V(Na2S2O3) Ч М(1/6 K2Cr2O7) Ч 100/10=0,1 Ч10 Ч49 Ч10=490 мг =0,49 г
T (Na2S2O3/ K2Cr2O7) = =0,005050 г/мл
C (Na2S2O3)= =0,1030 моль/л
T (Na2S2O3) = = 0,01629 г/мл
Приготовление медного щелочно-цитратного раствора(реактива Бенедикта)
Лимонная кислота C6H8O7
Мерная колба 250 см3
9,77 г сернокислой меди растворяют в 25 см3 дист. воды.
12,5 г лимонной кислоты растворяют отдельно в 13 см3 дист. воды.
35,9 г Углекислого безводного натрия так же отдельно растворяют в 125 см3 горячей дист. воды.
При проведении эксперимента альдегидные группы окисляются, а катионы меди восстанавливаются. Реактив Бенедикта склонен образовывать гидратированные оксиды, поэтому продукт реакции не всегда имеет красное окрашивание: он может быть также жёлтым или зелёным. Если содержание сахара мало, то осадок образуется только при охлаждении. Если восстанавливающие сахара отсутствуют, то раствор остаётся прозрачным. Растворы с содержанием сахара, равным 0,08 % дают заметный положительный результат, в то время как для реактива Фелинга эта величина равна 0,12 %
Приготовление рабочего исследуемого раствора.
Навеску измельченного исследуемого изделия берут из расчета, чтобы количество редуцирующих сахаров 1 см3 раствора было около 0,005 г
Массу навески вычисляют по формуле
где b-оптимальная концентрация редуцирующих сахаров г/ см3
V-вместимость мерной колбы, см3
Согласно ГОСТ 6442-89 Мармелад может содержать не более 20% редуцирующих сахаров от массы изделия.
Согласно ГОСТ 6441-96 Изделия кондитерские пастильные могут содержать от 10% до 25% редуцирующих сахаров от массы изделия.
Согласно ГОСТ 6477-88 Карамель может содержать не более 20 % редуцирующих сахаров от массы изделия.
Навеску в стакане растворяют в дистиллированной воде нагретой до 60?-70?С
Если изделие растворяется без остатка, то полученный раствор охлаждают и переносят в мерную колбу вместимостью 250 см3 доводят той же водой до метки и хорошо перемешивают.
Если изделие имеет в своем составе вещества нерастворимые в воде- то после переноса навески в мерную колбу, помещают ее на водяную баню на 10-15 минут, затем фильтруют, охлаждают и доводят дистиллированной водой до метки.
В коническую колбу вместимость 250 см3 вносят пипетками 25см3 щелочного цитратного раствора меди, 10 см3 исследуемого раствора и 15 см3 дистиллированной воды. Колбу подсоединяют к обратному холодильник и в течение 3-4 минут доводят до кипения и кипятят 10 минут, во время кипячения наблюдаем качественную реакцию глюкозы с гидрооксидом меди: поскольку глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу, она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора Бенедикта. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы Cu2O красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
Колбу быстро охлаждают до комнатной температуры.
В остывшую жидкость прибавляют 10 см3 KI р-р 30%, и 25 см3 раствора pSO4 концентрации 4 моль/дм3. Серную кислоту приливают осторожно во избежание ее выплескивания из колбы за счет выделившегося углекислого газа. После этого сразу титруют выделившийся йод раствором тиосульфата натрия до светло-желтой окраски жидкости.
Затем приливают 2-3см3 1% раствора крахмала и продолжают титровать окрасившуюся в грязно синий цвет жидкость до появления молочно-белого окрашивания. Фиксируют количество тиосульфата, которое пошло на титрование. Опыт повторяют 3 раза.
Контрольный опыт проводится в тех же условиях, для чего берут 25 см3 щелочного цитратного раствора меди и 25 см3 дистиллированной воды.
Массовую долю редуцирующих сахаров (Х) в процентах вычисляют по формуле
Где m-навески изделия, г
V-вместимость мерной колбы, см3
V1-объем исследуемого раствора, взятый для анализа, см3
Обсуждение результатов исследования
Определение содержания редуцирующих сахаров в мармеладе.
Объем тиосульфата натрия пошедшего на титрование
- Пожарные автомобили должны находиться в гараже с температурой не ниже
- Поздравление нянечке детского сада на выпускной