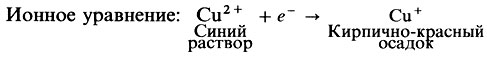Редуцирующие сахара что это
Редуцирующие сахара что это
5.2.2. Дисахариды
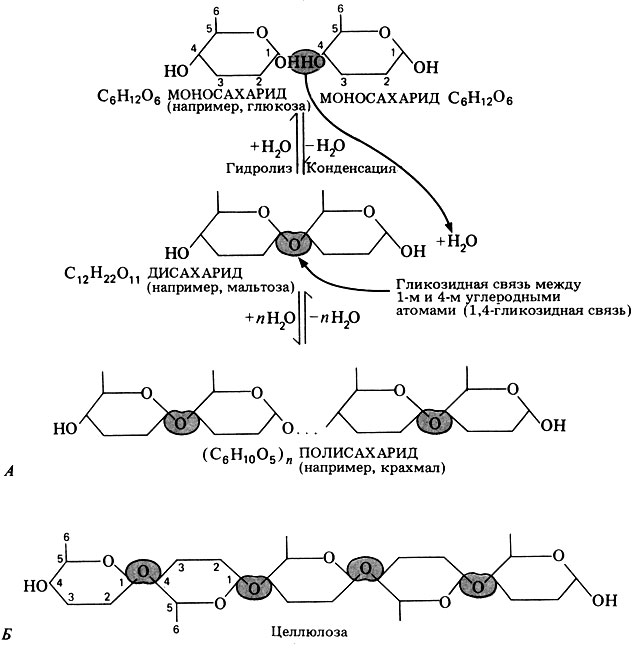
На рис. 5.6 отмечены некоторые свойства дисахаридов. Дисахариды образуются в результате реакции конденсации между двумя моносахаридами, обычно гексозами (рис. 5.14).
Рис. 5.14. А Образование дисахарида и полисахарида. Показаны лишь те части молекул, которые в данном случае представляют для нас интерес. Полностью молекула глюкозы представлена на рис. 5.13. Б. Строение целлюлозы. У некоторых полисахаридов, например у целлюлозы, присоединяемые моносахаридные единицы при каждой очередной конденсации поворачиваются на 180°
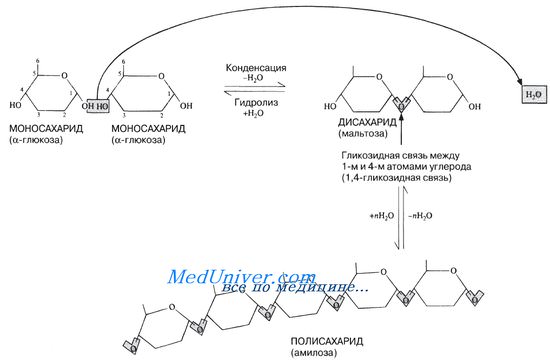
Связь между двумя моносахаридами называют гликозидной связью. Обычно она образуется между 1-м и 4-м углеродными атомами соседних моносахаридных единиц (1,4-гликозидная связь). Этот процесс может повторяться бессчетное число раз, в результате чего и возникают гигантские молекулы полисахаридов (рис. 5.14). После того как моносахаридные единицы соединятся друг с другом, их называют остатками. Таким образом, мальтоза состоит из двух остатков глюкозы.
Среди дисахаридов наиболее широко распространены мальтоза, лактоза и сахароза:
Мальтоза образуется из крахмала в процессе его переваривания (например, в организме животных или при прорастании семян) под действием ферментов, называемых амилазами. Расщепление мальтозы до глюкозы происходит под действием фермента, называемого мальтозой. Лактоза, или молочный сахар, содержится только в молоке. Сахароза, или тростниковый сахар, наиболее распространена в растениях. Здесь она в больших количествах транспортируется по флоэме. Иногда она откладывается в качестве запасного питательного вещества, так как метаболически она довольно инертна. Промышленным способом сахарозу получают из сахарного тростника или из сахарной свеклы; именно она и есть тот самый «сахар», который мы обычно покупаем в магазине.
Редуцирующие сахара
Редукции сахара: методы определения, важность
Содержание:
Эта карбонильная группа состоит из атома углерода, присоединенного к атому кислорода через двойную связь. Эта группа может находиться в разных положениях в молекулах сахара, что приводит к образованию других функциональных групп, таких как альдегиды и кетоны.
Альдегиды и кетоны содержатся в молекулах простых сахаров или моносахаридов. Указанные сахара классифицируются на кетозы, если они имеют карбонильную группу внутри молекулы (кетон), или на альдозы, если они содержат ее в концевом положении (альдегид).
Из всех существующих типов углеводов моносахариды являются восстанавливающими сахарами. Например, глюкоза, галактоза и фруктоза действуют как восстановители.
В некоторых случаях моносахариды являются частью более крупных молекул, таких как дисахариды и полисахариды. По этой причине некоторые дисахариды, такие как мальтоза, также ведут себя как восстанавливающие сахара.
Методы определения редуцирующих сахаров
Тест Бенедикта
Чтобы определить наличие редуцирующих сахаров в образце, его растворяют в кипящей воде. Затем добавьте небольшое количество реактива Бенедикта и подождите, пока раствор достигнет комнатной температуры. Через 10 минут раствор должен начать менять цвет.
Если цвет меняется на синий, значит, в нем нет восстанавливающих сахаров, особенно глюкозы. Если в исследуемом образце присутствует большое количество глюкозы, изменение цвета будет прогрессировать до зеленого, желтого, оранжевого, красного и, наконец, коричневого.
Реагент Бенедикта представляет собой смесь нескольких соединений: он включает безводный карбонат натрия, цитрат натрия и пентагидрат сульфата меди (II). После добавления в раствор с образцом начнутся возможные окислительно-восстановительные реакции.
Если присутствуют редуцирующие сахара, они восстановят сульфат меди (синий цвет) в растворе Бенедикта до сульфида меди (красноватый цвет), который выглядит как осадок и отвечает за изменение цвета.
Невосстанавливающие сахара не могут этого сделать. Этот конкретный тест дает только качественное понимание присутствия редуцирующих сахаров; то есть указывает, есть ли в образце редуцирующие сахара.
Реагент Фелинга
Подобно тесту Бенедикта, тест Фелинга требует, чтобы образец был полностью растворен в растворе; Это делается в присутствии тепла, чтобы он полностью растворился. После этого добавляют раствор Фелинга при постоянном перемешивании.
Если присутствуют редуцирующие сахара, раствор должен начать менять цвет в виде оксида или красного осадка. Если редуцирующие сахара отсутствуют, раствор останется синим или зеленым. Раствор Фелинга также готовят из двух других растворов (А и В).
Раствор A содержит пентагидрат сульфата меди (II), растворенный в воде, а раствор B содержит тетрагидрат тартрата натрия-калия (соль Рошеля) и гидроксид натрия в воде. Два раствора смешивают в равных частях, чтобы получить окончательный тестовый раствор.
Этот тест используется для определения моносахаридов, в частности альдоз и кетозов. Они обнаруживаются, когда альдегид окисляется до кислоты и образует оксид меди.
При контакте с альдегидной группой он восстанавливается до иона одновалентной меди, который образует красный осадок и указывает на присутствие редуцирующих сахаров. Если бы в образце не было восстанавливающих сахаров, раствор оставался бы синим, что указывало бы на отрицательный результат этого теста.
Реагент Толленса
В тесте Толленса используется смесь, известная как реагент Толленса, которая представляет собой щелочной раствор, содержащий ионы серебра, координированные с аммиаком.
Этот реагент недоступен в продаже из-за его короткого срока хранения, поэтому перед использованием его необходимо приготовить в лаборатории.
Подготовка реагента состоит из двух этапов:
Шаг 1
Водный раствор нитрата серебра смешивают с водным гидроксидом натрия.
Шаг 2
По каплям добавляют водный раствор аммиака до полного растворения осажденного оксида серебра.
Реагент Толленса окисляет альдегиды, присутствующие в соответствующих восстанавливающих сахарах. Та же реакция включает восстановление ионов серебра из реактива Толленса, который превращает их в металлическое серебро. Если тест проводится в чистой пробирке, образуется осадок серебра.
Таким образом, положительный результат с реактивом Толленса определяется по наблюдению «серебряного зеркала» внутри пробирки; этот зеркальный эффект характерен для этой реакции.
Важность
Определение присутствия редуцирующих сахаров в различных образцах важно в нескольких отношениях, включая медицину и гастрономию.
Значение в медицине
Тестирование на уровень редуцирующего сахара использовалось в течение многих лет для диагностики пациентов с диабетом. Это может быть сделано, потому что это заболевание характеризуется повышением уровня глюкозы в крови, определение которого может быть выполнено этими методами окисления.
Измеряя количество окислителя, восстановленное глюкозой, можно определить концентрацию глюкозы в образцах крови или мочи.
Это позволяет проинструктировать пациента о том, какое количество инсулина нужно вводить, чтобы вернуть уровень глюкозы в крови в нормальный диапазон.
Реакция Майяра
Реакция Майяра включает в себя набор сложных реакций, возникающих при приготовлении некоторых продуктов. При повышении температуры пищи карбонильные группы восстанавливающих сахаров вступают в реакцию с аминогруппами аминокислот.
Эта реакция приготовления приводит к образованию различных продуктов, и, хотя многие из них полезны для здоровья, другие токсичны и даже канцерогены. По этой причине важно знать химический состав редуцирующих сахаров, которые входят в обычный рацион.
При приготовлении продуктов, богатых крахмалом, таких как картофель, при очень высоких температурах (выше 120 ° C) возникает реакция Майяра.
Эта реакция происходит между аминокислотой аспарагин и восстанавливающими сахарами с образованием молекул акриламида, который является нейротоксином и, возможно, канцерогеном.
Качества продуктов питания
Качество определенных продуктов можно контролировать с помощью методов определения пониженного содержания сахара. Например: в винах, соках и сахарном тростнике уровень редуцирующих сахаров определяется как показатель качества продукта.
Для определения редуцирующих сахаров в пищевых продуктах в качестве индикатора восстановления оксидов обычно используется реагент Фелинга с метиленовым синим. Эта модификация широко известна как метод Лейна-Эйнона.
Разница между редуцирующими и невосстанавливающими сахарами
Разница между восстанавливающими и невосстанавливающими сахарами заключается в их молекулярной структуре. Углеводы, которые восстанавливают другие молекулы, делают это, отдавая электроны со своих свободных альдегидных или кетоновых групп.
Следовательно, невосстанавливающие сахара не имеют в своей структуре свободных альдегидов или кетонов. Следовательно, они дают отрицательные результаты в тестах на обнаружение редуцирующих сахаров, таких как тесты Фелинга или Бенедикта.
Восстанавливающие сахара включают все моносахариды и некоторые дисахариды, тогда как невосстанавливающие сахара включают некоторые дисахариды и все полисахариды.
Ссылки
Классическая древность: периоды и их характеристики
Редуцирующие сахара
Отработка методики количественного определения редуцирующих сахаров в рабочем растворе. Установление соответствия нормальным содержаниям редуцирующих сахаров в кондитерских изделиях, содержащихся в ГОСТе, формирование их потребительских свойств.
Сахар. Редуцирующие сахара
Значение сахаров для организма
Методы определения сахара в кондитерских изделиях
Приготовление медного щелочно-цитратного раствора(реактива Бенедикта)
Обсуждение результатов исследования
1. Определение содержания редуцирующих сахаров в мармеладе
2. Определение содержания редуцирующих сахаров в пастиле
3. Определение содержания редуцирующих сахаров в карамели
Йодометрией называют метод объемного анализа, в ос-нове которого лежат реакции:
Методом йодиметрии можно определять как окисли-тели, так и восстановители.
Определение окислителей. Методом йодиметрии можно определять те окислители, которые количественно окисляют IЇ в свободный I2. Чаще всего определяют перманганаты, бихроматы, соли меди (II), соли желе-за (III), свободные галогены и др. Индикатором в методе йодиметрии служит раствор крахмала. Это чувствительный и специфический инди-катор, образующий с йодом адсорбционное соединение синего цвета.
Отработка методики количественного определения редуцирующих сахаров в рабочем растворе.
Установить соответствие нормальным содержаниям редуцирующих сахаров в кондитерских изделиях содержащихся в ГОСТ
Основным сырьем для производства кондитерских товаров служат сахар, инвертный сироп, мука, жиры, молоко. Кроме того, при производстве кондитерских изделий используются фрукты и ягоды, орехи, какао-бобы, мед, пряности также многие другие продукты.
В формировании потребительских свойств кондитерских изделий большая роль придается продуктам, которые придают им структуру, внешний вид, вкус и цвет: студнеобразователям, эмульгаторам, пенообразователям, красителям, ароматизаторам.
редуцирующий сахар кондитерский потребительский
Сахар. Редуцирующие сахара
Инвертный сироп служит заменителем патоки, так как обладает антикристаллизационными свойствами. Получают инвертный сироп нагреванием водного раствора сахара с кислотой, при этом происходит процесс инверсии, заключающийся в расщеплении сахарозы на фруктозу и глюкозу. Для инверсии используются кислоты: соляная, лимонная, молочная, уксусная.
Все моносахариды, в случае с сиропом глюкоза и фруктоза, и некоторые дисахариды, в том числе мальтоза и лактоза, относятся к группе редуцирующих (восстанавливающих) сахаров, т. е. соединений, способных вступать в реакцию восстановления.
Реакция Фелинга наиболее часто используется для доказательства восстанавливающих свойств сахаров, она заключается в восстановлении моносахаридами гидроксида меди (II) в закись меди (I). При проведении реакции используется реактив Фелинга, представляющий собой смесь сульфата меди с сегнетовой солью (калий, натрий виннокислый) в щелочной среде. При смешивании сульфата меди со щелочью образуется гидроксид меди.
В присутствии сегнетовой соли выделившийся гидроксид не выпадает осадок, а образует растворимое комплексное соединение меди (II), которое восстанавливается в присутствии моносахаридов с образованием закисной меди (I). При этом альдегидная или кетон- группа моносахарида окисляется до карбоксильной группы. Например, реакция глюкозы с реактивом Фелинга.
Значение сахаров для организма
Фруктоза менее распространена, чем глюкоза, и также быстро окисляется. Часть фруктозы в печени превращается в глюкозу, но для своего усвоения она не требует инсулина. Этим обстоятельством, а также значительно более медленным всасыванием фруктозы сравнительно с глюкозой в кишечнике, объясняется лучшая переносимость ее больными сахарным диабетом.
Методы определения сахара в кондитерских изделиях
Поскольку контроль содержания уровня сахара в организме необходим, существует целый ряд различных методов определения количества как общих, так и редуцирующих (инверсных) сахаров в кондитерских изделиях,
что является важной частью контроля качества производства данной продукции.
Метод основан на восстановлении щелочного раствора меди некоторым количеством раствора редуцирующих сахаров и определении количества образовавшегося оксида меди (1) или невосстановившейся меди йодометрическим способом.
Метод применяется для всех видов кондитерских изделий и полуфабрикатов, кроме мучных кондитерских изделий, полуфабрикатов для тортов и пирожных и восточных сладостей.
Метод применяется при возникновении разногласий в оценке качества.
Метод основан на восстановлении соли железа (III) оксидом меди (I) и последующем титрова-нии восстановленного оксида железа (И) перманганатом.
Метод основан на измерении вращения плоскости поляризации света оптически активными ве-ществами.
Метод применяется для определения массовой доли общего сахара в шоколаде, пралине, какао- напитках, шоколадных пастах, сладких плитках, шоколадных полуфабрикатах без добавлений и с добавлением молока.
Приготовление и стандартизация раствора С(Na2S2O3)=0,1 моль/дм3
1. Мерная колба 100см3;
2. Мерный цилиндр вместимостью 25см3;
3. Коническая колба для титрования 250 см3
4. Бюретка на 25 мл
Рабочий раствор тиосульфата натрия готовят по навеске, исходя из заданной концентрации раствора и его объема. Для приготовления 200 мл 0,1 м раствора тиосульфата натрия отвешивают в бюксе на технических весах 5 г тиосульфата натрия. Взятую навеску растворяют в 200 мл дистиллированной воды и добавляют 0,02 г соды. Раствор хранят в склянке из темного стекла.
Определение точной концентрации раствора тиосульфата натрия проводится по 2—3 точным навескам дихромата калия полумикрометодом (бюретка объемом 25 мл, цена деления 0,1 мл). Навеску дихромата калия рассчитывают с учетом объема мерной колбы, пипетки, бюретки и концентрации приготовленного раствора тиосульфата натрия. Учитывая, что на титрование аликвоты раствора дихромата калия должно пойти 10 мл 0,1 М тио сульфата натрия и соотношение объема мерной колбы и пипетки
100 : 10, рассчитываем массу дихромата калия:
m(K2Cr2O7) = C(Na2S2O3) ЧV(Na2S2O3) ЧМ(1/6 K2Cr2O7) Ч100/10 = 0,1Ч 10 49Ч10 = 490 мг = 0,49 г.
Точная навеска дихромата калия лежит в пределах 0,47—0,51 г.Пробирку с дихроматом калия взвешивают на аналитических весах, отсыпают дихромат через воронку в мерную колбу на 100 мл и взвешивают пробирку с дихроматом калия. По разности взвешиваний находят навеску дихромата калия. Дистиллированной водой смывают дихромат калия с воронки в колбу, взбалтывают со держимое колбы до полного растворения дихромата калия
и только после этого доливают воду до метки. Раствор хорошо перемешивают. Пипетку на 10 мл промывают раствором дихромата калия
и отбирают 1/10 часть его в колбу для титрования объемом на 250 мл, добавляют 5 мл 10 % раствора KI и 5 мл 2 М раствора HCl. Колбу закрывают часовым стеклом и оставляют на 5 мин в темном месте. Затем к раствору добавляют 50 мл воды и титруют раствором тиосульфата натрия, добавляя его по каплям и хорошо перемешивая раствор. Когда окраска раствора из бурой перейдет в бледно-желтую, добавляют 50 капель раствора крахмала
(2—3 мл) и продолжают титрование до перехода синей окраски раствора в бледно-зеленую, почти бесцветную. При втором и последующих титрованиях крахмал добавляется возможно ближе к концу титрования. Отсчет объема раствора тиосульфата натрия ведется с точностью до ±0,005 мл. Титрование аликвотной части раствора дихромата калия проводят 3—4 раза и вычисляют среднее значение объема тиосульфата натрия (Vср.), относительное отклонение от среднего не более 0,5 %. По экспериментальным данным рассчитывают титр тиосульфата натрия по дихромату калия.
М(1/6 K2Cr2O7)=49 г/моль
М(Na2S2O3Ч 5pO)=248 г/моль
M (Na2S2O3)=158,11 г/мл
m(K2Cr2O7)= C(Na2S2O3) Ч V(Na2S2O3) Ч М(1/6 K2Cr2O7) Ч 100/10=0,1 Ч10 Ч49 Ч10=490 мг =0,49 г
T (Na2S2O3/ K2Cr2O7) = =0,005050 г/мл
C (Na2S2O3)= =0,1030 моль/л
T (Na2S2O3) = = 0,01629 г/мл
Приготовление медного щелочно-цитратного раствора(реактива Бенедикта)
Лимонная кислота C6H8O7
Мерная колба 250 см3
9,77 г сернокислой меди растворяют в 25 см3 дист. воды.
12,5 г лимонной кислоты растворяют отдельно в 13 см3 дист. воды.
35,9 г Углекислого безводного натрия так же отдельно растворяют в 125 см3 горячей дист. воды.
При проведении эксперимента альдегидные группы окисляются, а катионы меди восстанавливаются. Реактив Бенедикта склонен образовывать гидратированные оксиды, поэтому продукт реакции не всегда имеет красное окрашивание: он может быть также жёлтым или зелёным. Если содержание сахара мало, то осадок образуется только при охлаждении. Если восстанавливающие сахара отсутствуют, то раствор остаётся прозрачным. Растворы с содержанием сахара, равным 0,08 % дают заметный положительный результат, в то время как для реактива Фелинга эта величина равна 0,12 %
Приготовление рабочего исследуемого раствора.
Навеску измельченного исследуемого изделия берут из расчета, чтобы количество редуцирующих сахаров 1 см3 раствора было около 0,005 г
Массу навески вычисляют по формуле
где b-оптимальная концентрация редуцирующих сахаров г/ см3
V-вместимость мерной колбы, см3
Согласно ГОСТ 6442-89 Мармелад может содержать не более 20% редуцирующих сахаров от массы изделия.
Согласно ГОСТ 6441-96 Изделия кондитерские пастильные могут содержать от 10% до 25% редуцирующих сахаров от массы изделия.
Согласно ГОСТ 6477-88 Карамель может содержать не более 20 % редуцирующих сахаров от массы изделия.
Навеску в стакане растворяют в дистиллированной воде нагретой до 60?-70?С
Если изделие растворяется без остатка, то полученный раствор охлаждают и переносят в мерную колбу вместимостью 250 см3 доводят той же водой до метки и хорошо перемешивают.
Если изделие имеет в своем составе вещества нерастворимые в воде- то после переноса навески в мерную колбу, помещают ее на водяную баню на 10-15 минут, затем фильтруют, охлаждают и доводят дистиллированной водой до метки.
В коническую колбу вместимость 250 см3 вносят пипетками 25см3 щелочного цитратного раствора меди, 10 см3 исследуемого раствора и 15 см3 дистиллированной воды. Колбу подсоединяют к обратному холодильник и в течение 3-4 минут доводят до кипения и кипятят 10 минут, во время кипячения наблюдаем качественную реакцию глюкозы с гидрооксидом меди: поскольку глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу, она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора Бенедикта. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы Cu2O красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
Колбу быстро охлаждают до комнатной температуры.
В остывшую жидкость прибавляют 10 см3 KI р-р 30%, и 25 см3 раствора pSO4 концентрации 4 моль/дм3. Серную кислоту приливают осторожно во избежание ее выплескивания из колбы за счет выделившегося углекислого газа. После этого сразу титруют выделившийся йод раствором тиосульфата натрия до светло-желтой окраски жидкости.
Затем приливают 2-3см3 1% раствора крахмала и продолжают титровать окрасившуюся в грязно синий цвет жидкость до появления молочно-белого окрашивания. Фиксируют количество тиосульфата, которое пошло на титрование. Опыт повторяют 3 раза.
Контрольный опыт проводится в тех же условиях, для чего берут 25 см3 щелочного цитратного раствора меди и 25 см3 дистиллированной воды.
Массовую долю редуцирующих сахаров (Х) в процентах вычисляют по формуле
Где m-навески изделия, г
V-вместимость мерной колбы, см3
V1-объем исследуемого раствора, взятый для анализа, см3
Обсуждение результатов исследования
Определение содержания редуцирующих сахаров в мармеладе.
Объем тиосульфата натрия пошедшего на титрование
Редуцирующие сахара что это
Лактоза, или молочный сахар, содержится только в молоке и служит важным источником энергии для детенышей млекопитающих. Она переваривается медленно и потому способна обеспечивать постоянный стабильный приток энергии.
Сахароза, или тростниковый сахар — самый распространенный в природе полисахарид. Чаще всего она встречается в растениях, где в больших количествах транспортируется по флоэме. Сахароза особенно пригодна для этого, так как благодаря ее высокой растворимости она может транспортироваться в виде весьма концентрированных растворов.
В химическом отношении сахароза довольно инертна, т. е. при перемещении из одного места в другое она практически не вовлекается в метаболизм. По этой же причине сахароза иногда откладывается в качестве запасного питательного вещества. Промышленным способом сахарозу получают из сахарного тростника или сахарной свеклы; именно она и есть тот самый «сахар»,который мы обычно покупаем в магазине.
Редуцирующие сахара
Все моносахариды и некоторые дисахариды, в том числе мальтоза и лактоза, относятся к группе редуцирующих (восстанавливающих).
Сахаров, т. е. соединений, способных вступать в реакцию восстановления. Сахароза представляет собой единственный нередуцирующий сахар среди распространенных Сахаров. Две обычные реакции на редуцирующие сахара — реакция Бенедикта и реакция Фелинга — основаны на способности этих Сахаров восстанавливать ион двухвалентной меди до одновалентной. В обеих реакциях используется щелочной раствор сульфата меди(II) (CuSO4), который восстанавливается до нерастворимого оксида меди(1) (Cu20).
Лекция на тему «Углеводы»
Тема: Редуцирующие и нередуцирующие сахара
Моносахариды и большинство дисахаридов обладают редуцирующей способностью, все они обязаны (альдегидной) карбоксильной группе, которую они имеют в своей же молекуле. Свободный конец атома используется путем передачи электонов другой свободной молекуле. Их открытая химическая структура (с двумя кольцами химических веществ) позволяет им разбиваться с удвоенной скоростью дисахаридов.
Этот редуцирующий характер можно продемонстрировать с помощью окислительно-восстановительной реакции, проводимой между ними и сульфатом меди (II). Растворы этой соли имеют синий цвет. После реакции с восстановительным углеводным оксидом меди (I) образуется кирпично-красный цвет. Таким образом, изменение цвета указывает на то, что указанная реакция произошла и что, следовательно, данный углевод редуцирующий. Ученые используют несколько обычных химических составов на определение редуцирующего сахара: самые распространенные реакция Бенедикта и реакция Фелинга.
Сахара, которые дают положительные результаты по тестам известны как редуцирующие сахара. Положительный результат дают сахара с полуацетальную или гемикетальную группой. Но я не буду их рассматривать(это для общего понятия).
Самыми распространенными сахарами в продуктах питания являются глюкоза и фруктоза (моносахариды), а в меньшей степени лактоза и галактоза(дисахариды). Ряд сахаров или сахароза не является редуцирующим сахаром, но если сахарный раствор нагревается или подкисляется, идет гидролиз: сахароза разрушается до глюкозы и фруктозы, а это уже моносахариды. И они редуцируются.
Это углеводы – полисахариды. Самая распространенная – сахароза. Имеет закрытую (замкнутую )химическую структуру. У нее несколько химических колец(три), где открытые атомы используются для связывания структуры в целом и, следовательно, не имеют свободных электронов для отдачи связующей молекуле. Из-за этого окисления нет во время реакции. Чтобы вызвать разложение, понадобится гораздо больше времени.
У нередуцирующего сахара нет реакционной способности, нет альдегидной группы, поэтому тест Бенедикта дает отрицательный результат.

2. Раствор фруктозы + 2 капли реактива Бенедикта
3. Раствор глюкозы + 2 капли реактива Бенедикта
4. Раствор лактозы + 2 капли реактива Бенедикта