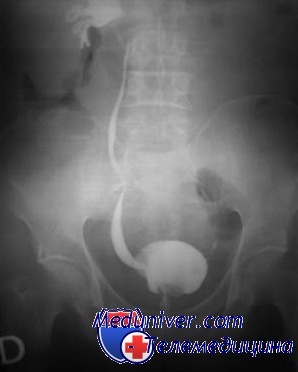
Рефлюкс почки у ребенка что это
Рефлюкс почки у ребенка что это
Частота нефросклероза рефлюкс-нефропатии зависит от степени рефлюкса. Рефлюкс имеет тенденцию уменьшаться и даже полностью исчезать по мере роста мочевого пузыря. Спонтанное выздоровление более вероятно при слабом рефлюксе. При рефлюксе I или II степени так одно-, так и двустороннем вероятность спонтанного выздоровления одинакова и не зависит от возраста пациента, в котором поставлен диагноз.
При рефлюксе III степени спонтанное выздоровление более вероятно, если он односторонний и диагноз поставлен в раннем возрасте. При двустороннем рефлюксе IV степени вероятность спонтанного выздоровления значительно ниже, чем при одностороннем. При рефлюксе V степени оно маловероятно. В среднем спонтанное выздоровление наступает в возрасте 6-7 лет. В отсутствие инфекции поражения паренхимы почек рефлюкс, как правило, не вызывает. Однако активный рефлюкс (рефлюкс высокого давления), характерный для клапанов проксимальной части мочеиспускательного канала, нейрогенного мочевого пузыря и синдрома Хинмана (ненейрогенного нейрогенного мочевого пузыря) может значительно повреждать паренхиму. Рефлюкс высокой степени в сочетании с ИМП во многих случаях сопровождается пиелонефритом и пиелонефритическим нефросклерозом.
Цель лечения — предотвратить пиелонефрит, повреждение почечной паренхимы и другие осложнения пузырно-мочеточникового рефлюкса. Консервативная тактика основана на том, что рефлюкс с возрастом нередко исчезает спонтанно, следовательно, надо только предупредить его осложнения. Оперативное вмешательство показано, когда рефлюкс уже вызвал повреждение почечной паренхимы или вероятность его и других осложнений значительна.
Краеугольный камень консервативной терапии рефлюкса — постоянное профилактическое применение антибактериальных препаратов, обычно триметоприм/сульфаметоксазола, одного триметоприма или нитрофурантоина ежедневно в дозе, равной 1/3-1/4 используемой для лечения острого пиелонефрита. Антибактериальную профилактику обычно продолжают до спонтанного исчезновения рефлюкса или того момента, когда опасность повреждения почечной паренхимой станет незначительной. При расстройстве мочеиспускания и запоре необходима их коррекция. При инфекции мочевых путей (ИМП) показано бактериологическое исследование мочи.
Микционную цистоуретрографию (рентгенологическую или радионуклидную), как правило, повторяют каждые 12-18 мес. Периодически проводят и визуализирующее исследование для оценки состояния верхних отделов мочевой системы. Ребенка осматривают не реже 1 раза в год с обязательным определением роста, массы тела и АД.
Консервативное ведение с профилактическим применением антибактериальных препаратов считают успешным, если не возникают рецидивы ИМП, новые очаги нефросклероза и рефлюкс спонтанно исчезает. Наоборот, рецидивы инфекции, появление новых рубцов в почечной паренхиме и стойкость рефлюкса свидетельствуют о неудаче. Препятствуют консервативному ведению или делают его неэффективным несоблюдение врачебных рекомендаций, аллергические реакции на антибактериальный препарат или его побочное действие.
Хирургическое вмешательство проводят эндоскопически или через нижний разрез брюшной стенки. Открытая операция заключается в реимплантации мочеточника с увеличением в 4-5 раз диаметра его сегмента, проходящего в стенке мочевого пузыря. Описано множество технических вариантов этой операции. Некоторые из них (Политано-Лидбеттера, транстригональный Коэна, Гленна-Андерсона) требуют рассечения мочевого пузыря. При простом удвоении оба мочеточника имплантируют вместе («в одном влагалище»). Резкое расширение мочеточника (мегауретер), сопутствующее рефлюксу, требует хирургической коррекции. Мочеточник подвергают равномерному или коническому сужению, чтобы достигнуть нормального соотношения длины и диаметра его интрамурального отрезка, а угол мочевого пузыря прикрепляют к сухожилию поясничной мышцы («поясничный скреп»). При недостаточности почки со стороны рефлюкса показана нефрэктомия или нефроуретерэктомия. Разрабатывают методы лапароскопической коррекции рефлюкса внепузырным доступом.
Открытая операция показана при неэффективности консервативного ведения (рецидивироние ИМП, стойкий рефлюкс) и при рефлюксе IV и V степени. Как правило, она не сопровождается значительной кровопотерей. Продолжительность госпитализации после нее составляет в среднем 2 дня. Хирургическое лечение устраняет рефлюкс I-IV степени в 95-98 % случаев. В 2 % наблюдений рефлюкс сохраняется, в 1 % требуется дополнительная коррекция обструкции мочеточника. Хирургическое вмешательство настолько эффективно, что микционную цистоуретрографию после него выполняют только при развитии пиелонефрита. Рефлюкс V степени удается устранить приблизительно в 80 % случаев.
Основная причина неудач при рефлюксе меньшей степени — нераспознанные расстройства мочеиспускания. При вторичном рефлюксе процент неудач несколько выше, чем при первичном.
Эндоскопическая коррекция рефлюкса состоит во введении под слизистую оболочку вещества создающего вокруг устья мочеточника выступает искусственный клапан. Этот метод называют субуретеральной инъекцией. Его преимущества — неинвазивность и возможность амбулаторного проведения (под общей анестезией). Он устраняет рефлюкс в 70-80 % случаев. Эффетивность тем выше, чем ниже степень рефлюкса. В октябре 2001 г. FDA одобрило использование для субуретеральной инъекции суспензии микросфер декстрана в гиалуроновой кислоте (дефлюкс). В Европе с этой целью используют препарат стихи. Другие средства для субуретеральной инъекции находятся в стадии апробации.
По данным международного исследования, при рефлюксе III-IV степени результаты в отношении нефросклероза и функции почек через 5 лет после хирургического или консервативного лечения одинаковы, но частота пиелонефрита у лечившихся консервативно детей в 2,5 раза выше. У более чем 50 % из них к концу исследования еще был рефлюкс.
Американская урологическая ассоциации опубликовала в 1997 г. основанные на принципах доказательной медицины рекомендаций по лечению пузырно-мочеточникового рефлюкса диагностированного после возникновения инфекции мочевых путей, разработанные до того, как FDA одобрило средство для эндоскопической субуретеральной инъекции. Врач должен ознакомить родителей предстоящим подходом к лечению и обсудить с ними оптимальный для их ребенка вариант. Выбор консервативного или активного ведения зависит от степени риска ИМП и нефросклероза, вероятности спонтанного исчезновения рефлюкса и предпочтений родителей и самого больного.
— Вернуться в оглавление раздела «физиология человека»
Пузырно мочеточниковый рефлюкс у детей причины симптомы и лечение.
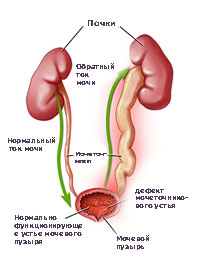
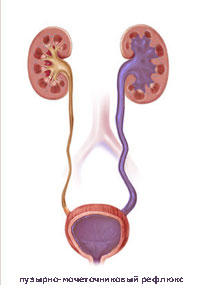
Что такое пузырно-мочеточниковый рефлюкс?
Когда у ребенка пузырно-мочеточниковый рефлюкс, механизм, предотвращающий обратный ток мочи не работает, позволяя моче течь в обоих направлениях. Ребенок, у которого диагностируется пузырно-мочеточниковый рефлюкс, подвергается риску инфицирования почек, которое со временем может привести к повреждению и образованию рубцов на почке.
Причины пузырно-мочеточникового рефлюкса
Существует много различных причин для развития пузырно-мочеточникового рефлюкса у детей. Наиболее часто встречаемые причины:
Симптомы пузырно-мочеточникового рефлюкса
Ниже приведены наиболее распространенные симптомы пузырно-мочеточникового рефлюкса. Однако, каждый ребенок может испытывать симптомы по-разному. Различают следующие симптомы:
Симптомы пузырно-мочеточникового рефлюкса неспецифичны, встречаются и при других патологиях мочеполовой системы. Поэтому необходимо при наличии какого-либо симптома обратиться к вашему врачу для постановки диагноза..
Диагноз пузырно-мочеточникового рефлюкса
Пузырно-мочеточниковый рефлюкс, как правило, можно обнаружить при ультразвуковом исследовании плода еще в утробе матери. Если отягощен семейный анамнез (наличие у родственников пузырно-мочеточникового рефлюкса), но у вашего ребенка нет симптомов поражения мочеполовой системы, то ваш доктор может назначить ряд исследований с диагностической целью для выявления или исключения данной патологии. Различают следующие виды диагностических исследований:
Лечение пузырно-мочеточникового рефлюкса
Пузырно-мочеточниковый рефлюкс может проявляться в различных степенях тяжести. При легкой степени тяжести отмечается обратный ток мочи на короткое расстояние в мочеточнике. При тяжелой степени тяжести пузырно-мочеточниковый рефлюкс ведет к инфицировании почек и постоянному повреждению почек. Выбор тактики лечения пузырно-мочеточникового рефлюкса определяет ваш лечащий доктор, основываясь на:
Существует также оценка тяжести состояния по стадиям (от 1 до 5) для выявления степени рефлюкса у вашего ребенка. Чем выше стадия, тем тяжелее степень пузырно-мочеточникового рефлюкса.
Большинство детям с пузырно-мочеточниковым рефлюксом 1-3 стадии, то есть, легкой или средней степени тяжести, не требуется интенсивная терапия. Возможно саморазрешение заболевания с течением времени, обычно в течение 5 лет. Детям, у которых развиваются частые лихорадки или подвергаются частым инфекциям, необходимо назначить антибактериальную терапию с целью предотвращения осложнений, а также необходим периодический контроль анализов мочи. Детям с пузырно-мочеточниковым рефлюксом 4 или 5 стадии (тяжелой степени) показано хирургическое вмешательство. Во время операции, доктор создает клапанный аппарат мочеточника, который позволяет предотвратить обратный ток мочи в мочеточники и почки. В более тяжелых случаях, зарубцеванную почку и мочеточник, возможно, потребуется удалить хирургическим путем.
Насколько срочно нужно лечить ПМР?
Абсолютно показано оперативное лечение рефлюкса эндоскопическим или хирургическим методом, независимо от степени и возраста пациента, при рецидивирующем остром пиелонефрите. Рефлюкс 3-5 степени без обострений пиелонефрита так же, как правило, лечат оперативными методами. Стерильный рефлюкс 1-3 степени без воспалительных изменений в анализах мочи может быть оставлен под наблюдением.
Каков принцип хирургического лечения ПМР?
До настоящего времени в большинстве урологических отделений проводится хирургическое лечение пузырно-мочеточникового рефлюкса. Операции выполняются на открытом мочевом пузыре. Задачей антирефлюксных операций является создание туннеля под слизистой оболочкой мочевого пузыря, в который помещается участок мочеточника. При этом моча, заполняющая мочевой пузырь, прижимает эластичную верхнюю стенку мочеточника к нижней, препятствуя проникновению мочи из мочевого пузыря в мочеточник.
Каковы недостатки хирургического лечения ПМР?
Лапароскопическое лечение пузырно-мочеточникового рефлюкса
Лапароскопия при пузырно-мочеточниковом рефлюксе изучается, как новая альтернатива обычным хирургическим вмешательствам открытым доступом. Первоначальные попытки лечения рефлюкса были успешными, но требовали достаточно много времени, чтобы осуществить операцию. Появление новых технологий способствует усовершенствованию медицины и в том числе малоинвазивная лапароскопическая операция, которая представляется более эффективным методом лечения. Хотя при этом сохраняется высокий процент успешных операций открытым доступом, и составляет около 98 %, с минимальным количеством осложнений. При одностороннем пузырно-мочеточниковом рефлюксе предпочтительным методом является лапароскопический доступ оперативного вмешательста с минимальным послеоперационным периодом и быстрым восстановлением. При лапароскопии существенным фактором является миниинвазивность (минимальный разрез, низкая травматичность тканей), в результате незначительные послеоперационные рубцы. Рубец при открытой хирургической операции остается внизу живота, который обычно прикрыт бельем. Продолжение технического усовершенствования метода, скорее всего, обеспечит хорошую альтернативу оперативным вмешательствам открытым доступом
Пузырно-мочеточниковый рефлюкс у детей
Содержание статьи
Пузырно-мочеточниковый рефлюкс (ПМР) – заболевание, при котором происходит обратный заброс мочи из мочевого пузыря в почку. Этот процесс обуславливается неправильной работой сфинктера, который запирает ток мочи в обратном направлении к мочеточнику и почке.
Это одна из самых распространенных урологических патологий, особенно среди детей. Врожденный ПМР диагностируется у 1 % детей. В первый год жизни девочки болеют в 5 раз чаще мальчиков. В более взрослом возрасте ситуация меняется в противоположную сторону. Многие пациенты в результате ПМР становятся инвалидами, потому что это заболевание имеет высокий риск серьезных осложнений – почечная недостаточность, гнойные патологии почек, вторичная артериальная гипертензия. Источник:
Ю.А. Ермолаева, О.П. Харина, С.Н. Иванов, Г.П. Филиппов
Современные представления о пузырно-мочеточниковом рефлюксе и рефлюкс-нефропатии в детском возрасте (обзор литературы) // Сибирский медицинский журнал, 2008, №4 (выпуск 2), с.111-119
Формы и степени ПМР у детей
Заболевание может быть первичным и вторичным. Причина ПМР первичного типа – врожденный дефект устья мочеточника либо стенки мочевого пузыря. Вторичное заболевание – это продолжение болезней мочевыводящей системы, например рецидивирующего цистита.
Также болезнь может быть постоянной или транзиторной. Постоянный ПМР присутствует всегда, а транзиторный появляется при других заболеваниях – остром простатите, цистите.
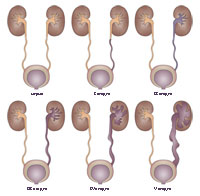
Степени ПМР
Рефлюкс малого объема мочи ограничен тазовым отделом мочеточника, который не расширен. Симптомов нет, риск осложнений минимален.
Заброс мочи по всей протяженности мочеточника, но без его расширения. Моча не доходит до почек и чашечно-лоханочной системы. Ярко выраженных симптомов нет, появляется небольшой риск получения инфекции, рефлюкс быстро прогрессирует.
Моча попадает в почки, но лоханки не расширяются. Почечная функция может быть снижена на 20 %. Мочеточник расширяется, моча застаивается в выделительной системе, что повышает риск инфекционного осложнения. Появляются средне выраженные симптомы.
Мочеточник существенно расширен, чашечно-лоханочная область деформирована, функция почек снижена на 50 %, вырабатывается меньше мочи. Выражена симптоматика, повышается температура тела, появляются отеки. Если ПМР двухсторонний, могут развиваться угрожающие жизни ребенка состояния.
Сохраняются все признаки предыдущих степеней, почки сильно поражены, их паренхима истончена. Мочеточник приобретает коленообразные изгибы. Нарастают симптомы почечной недостаточности – тошнота, рвота, снижение мочевыделения, кожный зуд.
Причины развития пузырно-мочеточникового рефлюкса
Общие причины появления пузырно-мочеточникового рефлюкса:
Какие симптомы ПМР могут быть у ребенка?
На ранних стадиях болезнь может протекать без симптомов. Первые признаки появляются при отсутствии лечения или присоединении инфекции.
При врожденном или приобретенном рефлюксе в раннем возрасте для детей характерны:
При утяжелении состояния развивается задержка мочи, повышается температура тела. Это признаки того, что присоединилась инфекция. У детей грудного возраста признаки инфекции – это отсутствие аппетита, диарея, раздражительность, лихорадка. Источник:
Н.А. Пекарева, Е.Ю. Пантелеева, С.А. Лоскутова
Особенности течения и диагностики пузырно-мочеточникового рефлюкса у детей // Педиатрия. Журнал им. Г.Н. Сперанского, 2008, т.87, №3, с.31-36
Чем старше ребенок, тем выраженнее рефлюкс, если отсутствует лечение:
Диагностика заболевания у детей
Диагноз ставит детский уролог. Обычно достаточно опроса пациента и его осмотра. Дополнительные методы диагностики позволяют определить причину и тяжесть патологии:
Методы лечения у детей
Для коррекции ПМР у детей может применяться диета, медикаментозное лечение, физиотерапия и операция, если у ребенка есть к ней показания.
Диета
Детям с таким заболеванием показан стол №7 по Певзнеру. Общие клинические рекомендации по диете №7 при ПМР у детей:
Необходимо исключить пряности, острые блюда, ограничить белок. В качестве источников белка разрешены яйца, нежирная птица, мясо, рыба. Количество белковых продуктов в рационе ребенка назначает его лечащий врач.
Полностью исключают из рациона:
Медикаментозное лечение
Для профилактики и лечения инфекций мочевыделительной системы ребенку показаны антибиотики, уросептики, фитотерапия или иммунотерапия. Применение антибиотиков оправдано тем, что чем меньше рецидивов пиелонефрита, тем ниже риск развития ПМР. После курса лечения, через полгода-год, делаю контрольную цистографию.
При I-III степени ПМР эффективность медикаментозного лечения достигает 70 %, у маленьких детей – до 90 %.
Физиотерапия
Физиотерапия – вспомогательный способ лечения, который сильно повышает эффективность основного лечения. Методы физиотерапии зависят от рефлекторной функции мышечной оболочки мочевого пузыря.
При гипорефлекторности назначают электрофорез с хлоридом кальция, прозерином, ультразвук на мочевой пузырь, электростимуляцию.
При гиперрефлекторности показаны: электрофорез с папаверином, атропином, ультразвук на мочевой пузырь, расслабляющая электростимуляция, магнитотерапия.
Хирургическое лечение
Если у ребенка высокая степень ПМР или неадаптированный мочевой пузырь, то показана операция. Она проводится по эндоскопической методике. Показания к операции:
Эндоскопическая операция проводится для того, чтобы усилить клапанный механизм. Для этого какое-либо вещество («Уродекс», коллаген или «Вантрис») имплантируется в подслизистый отдел устья мочеточника. Эта методика малоинвазивна, дети быстро восстанавливаются, есть возможность проводить вмешательства повторно. Недостаток – постепенное рассасывание или миграция введенного вещества, что приводит к необходимости оперировать снова.
Классическая хирургическая операция может быть, в зависимости от доступа, внутрипузырной, внепузырной или комбинированной. Общий принцип всех вмешательств – создание клапанного механизма путем формирования подслизистого тоннеля. Отношение диаметра мочеточника к длине тоннеля – 1:5. Самые распространенные операции – Коэна, Политано-Леадбеттера, Жиль-Вернэ, Гленн-Андерсона, Лич-Грегуара.
Если рефлюкс возникает вторично, то лечение сосредоточено на устранении тех факторов, которые его вызывают.
Если у ребенка присутствует такая врожденная патология, как клапан задней уретры, то створки это клапана резицируются эндоскопически. После этого устанавливается уретральный катетер и мочевой пузырь дренируется. Через 10 дней делают контрольную уретроскопию для решения вопроса о дальнейшем дренировании.
Методы профилактики
Если у ребенка хронический ПМР, то повышается риск инфицирования. Поэтому нужно регулярно показывать ребенка детскому урологу. Чтобы моча не задерживалась в мочевом пузыре, надо своевременно лечить болезни, которые вызывают такое состояние, – МКБ, стриктуры и др.
Эндоскопическая коррекция пузырно-мочеточникового рефлюкса у детей
Рассмотрено лечение пузырно-мочеточникового рефлюкса методом эндоскопической коррекции. Метод характеризуется рядом важных преимуществ – малой травматичностью, короткой продолжительностью оперативного вмешательства, возможностью применения в амбулаторных
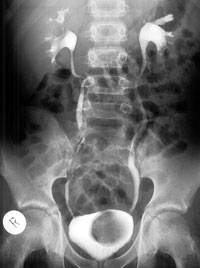
Пузырно-мочеточниковый рефлюкс (ПМР) — это ретроградный заброс мочи из мочевого пузыря в мочеточник и чашечно-лоханочную систему, обусловленный аномалией развития интрамурального отдела мочеточника (при первичном рефлюксе) или повышением внутрипузырного давления вследствие инфравезикальной обструкции или при нейрогенном мочевом пузыре (вторичный рефлюкс) (рис. 1). По данным литературы ПМР встречается приблизительно у 0,4–1,8% детей и является наиболее распространенной аномалией мочевыводящих путей в популяции [1–4]. Основной целью лечения ПМР является предупреждение рецидивирующего течения пиелонефрита, развития повреждений почечной паренхимы, гипертензии и хронической болезни почек.
Последнее десятилетие ознаменовалось значительными изменениями во взглядах на стандарты лечения и ведения детей с пузырно-мочеточниковым рефлюксом (ПМР). Дискутабельными на сегодняшний день являются вопросы эффективности проведения длительной антибактериальной терапии, метода оперативной коррекции рефлюкса и целесообразности лечения рефлюкса как такового [1, 2, 5]. Эндоскопическая коррекция рефлюкса (ЭКР) впервые была предложена в 1981 г. Matouschek Е. как альтернатива консервативной терапии и открытым операциям. В дальнейшем техника была усовершенствована и популяризирована O’Donnell B. и Puri P., которые в 1984 г. опубликовали результаты введения пасты тефлона (subureteric Teflon injection (STING)) [6, 7]. С тех пор с использованием различных имплантатов были пролечены тысячи детей с ПМР.
Повышенный интерес к данному виду лечения был обусловлен рядом важных его преимуществ — малой травматичностью, короткой продолжительностью оперативного вмешательства, возможностью применения в амбулаторных условиях, минимальным риском осложнений, характерных для различных реконструктивно-пластических неоимплантаций мочеточников и отсутствием необходимости длительной антибиотикотерапии.
По данным разных авторов эффективность эндоскопического метода варьирует от 52,4% (Lackgren G., 2002) до 86,7% (Hsieh M., 2010), поэтому считать окончательно решенной эту проблему нельзя. На наш взгляд, результаты эндоскопического лечения зависят от правильно выбранных показаний, техники выполнения процедуры и от используемого имплантата [8–10].
ЭКР проводится при следующих показаниях:
Проанализировав накопленный материал, мы пришли к выводу, что факторами, снижающими эффективность ЭКР, являются полное удвоение верхних мочевых путей и рецидив рефлюкса после реимплантации мочеточника.
Противопоказаниями к использованию метода ЭКР являются следующие условия:
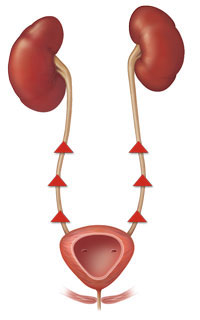
Суть эндоскопической коррекции рефлюкса заключается в восстановлении нарушенной антирефлюксной функции мочеточника путем введения под его выходной отдел жидкого инертного полимера. Полимер формирует бугорок, который после застывания служит жесткой опорой для мочеточника, верхняя стенка которого, плотно прилегая к нижней, обеспечивает клапанную антирефлюксную функцию (рис. 2).
.jpg)
Сегодня в клинической практике используется широкий спектр препаратов для ЭКР. Все они должны отвечать следующим требованиям: быть биологически совместимыми с тканями организма человека, безопасными и не мигрировать в другие ткани и органы.
Применяемые имплантаты можно разделить на две группы: нестабильные (рассасывающиеся) и стабильные (нерассасывающиеся). В последние пять лет в нашей клинике предпочтение отдается стабильным имплантатам Уродекс и Вантрис.
Уродекс (Urodex) представляет собой суспензию микрочастиц декстраномера (DEAE Сефадекс) и поперечно сшитых молекул гиалуроновой кислоты неживотного происхождения. Именно поперечно сшитые молекулы гиалуроновой кислоты и являются транспортным средством для микрочастиц декстраномера. Проведенные исследования показали, что Уродекс оказывает стимулирующее действие на соединительную ткань в месте инъекции, за счет возобновления синтеза волокон коллагена в ткани. Уродекс не токсичен, не карциногенен, не мигрирует в ткани и органы [11–14]. Через несколько лет он распадается на воду и углекислоту.
По собственным результатам использования Уродекса в период с 2008 по 2010 г. эффективность его применения составила 84,4%.
Вантрис (Vantris) представляет собой гидрогель синтетического происхождения, неабсорбируемое биологически совместимое объемообразующее вещество, разработанное компанией Promedon (Аргентина). Вантрис представляет собой макрочастицы cополимера полиакрилового и поливинилового спирта, диспергированного в 40%-ном растворе глицерина. После имплантации Вантриса глицерин полностью элиминируется ретикулоэндотелиальной системой и экскретируется почками в неизмененном виде, в то время как частицы кополимера осуществляют перманентную тканевую аугментацию. Размеры частиц Вантриса (90–1000 мкм, большинство из которых > 300 мкм) обуславливают отсутствие миграции. Частицы Вантриса имеют неправильную форму, эластичны и легко принимают необходимый вид, что позволяет свободно инсуфлировать гель через иглу 23-го калибра. Частицы выдерживают тканевые изменения температуры и кислотности [15, 16].
В 2011 г. в нашем отделении было пролечено 43 ребенка в возрасте от 7 месяцев до 13 лет (средний возраст 1,6 года) с ПМР II–V степени. У 14 больных ПМР был двусторонним, у 29 — односторонним (всего 57 мочеточников).
ПМР II степени был у 11 детей (25,6%), III степени — у 19 (44,1%), IV степени — у 9 (20,9%), 5 степени — у 4 больных (13,9%).
Эндоскопическая коррекция проводилась по стандартной методике, принятой в клинике (STING или HIT). Количество вводимого имплантата определялось индивидуально и варьировало от 0,4 до 0,9 мл. Всем детям в послеоперационном периоде проводилось ультразвуковое сканирование почек и мочевого пузыря, при котором оценивались размеры чашечно-лоханочной системы, мочеточника и размеры и локализация болюса имплантата. Контрольное ультразвуковое исследование проводилось через 1,3 и 6 месяцев, результат коррекции рефлюкса оценивался по данным микционной цистоуретрографии через 6 месяцев, статическая сцинтиграфия выполнялась через 1 год после оперативного лечения.
По данным микционной цистографии, проведенной через 5–10 месяцев после процедуры эндоскопической коррекции ПМР, рефлюкс не определялся в 46 мочеточниках (80,7% случаев), снижение степени рефлюкса до I–II отмечалось в 7 случаях (12,2%), эффекта не было (отрицательный результат) в 4 случаях (7%), при этом у 2 детей возникшая после введения Вантриса дилатация чашечно-лоханочной системы и мочеточника сохранялась в течение 6 месяцев и послужила поводом для неоимплантации мочеточников, у 2 детей степень рефлюкса сохранялась на прежнем уровне.
У всех пациентов в послеоперационном периоде зафиксировано более благоприятное течение пиелонефрита, по результатам проведенной статической сцинтиграфии почек через 8–12 месяцев (30 детей) признаков прогрессирования нефросклероза не отмечено.
Суммируя все вышесказанное, еще раз отметим, что наиболее надежные результаты эндоскопической коррекции ПМР можно получить в случае проведения правильной техники процедуры опытным хирургом. Эффективность ЭКР зависит от степени рефлюкса и первичности процедуры, т. к. неправильно выполненная предыдущая манипуляция резко снижает эффективность лечения из-за того, что устье мочеточника фиксируется в невыгодном положении. На результат ЭКР влияют грубые аномалии устья мочеточника и дисфункции мочевого пузыря. Мы убеждены, что при использовании нерассасывающихся паст Уродекс и Вантрис можно получить высокий процент излечения пузырно-мочеточникового рефлюкса.
Литература
С. Н. Зоркин, доктор медицинских наук, профессор
С. А. Борисова, кандидат медицинских наук
ФГБУ НЦЗД РАМН, Москва
.jpg)
.jpg)
.jpg)