Реиннервация что это такое
Реиннервация что это такое
Поражение лицевого нерва (ЛН) сопровождается грубым дефектом внешности и другими различными осложнениями, что может привести к тяжелой психологической травме и социальной дезадаптации. В настоящее время хирургическое лечение наиболее эффективно помогает восстановить функции лицевой мускулатуры. При стойких поражениях лицевого нерва (ЛН) это чрезвычайно сложная задача, поэтому любую успешную операцию можно назвать удачей. Многообразие видов хирургического лечения и отсутствие единого подхода, позволяющего восстановить движение всех мимических мышц, говорят о том, что проблема лечения этой патологии далека от решения 3.
Материал и методы

Все новообразования задней черепной ямки (ЗЧЯ) имели большие или гигантские размеры (в среднем 40,1 мм). В 18 (78,3%) случаях в ходе удаления опухоли ЗЧЯ отмечено анатомическое повреждение ЛН, у 3 (13%) больных ЛН был сохранен, но имелась его функциональная несостоятельность. У 2 (8,7%) пациентов, поступивших из других учреждений, уточнить анатомическую целостность ЛН не представлялось возможным. В связи с этим пациентам проводилось консервативное лечение в течение 6 мес.
По шкале House-Brackmann оценивалась дисфункция ЛН до и непосредственно после вмешательства, а также через 4 и 6 мес после операции. Тригеминальная невротизация выполнена больным с параличом ЛН VI степени по шкале House-Brackmann. Всем пациентам перед проведением невротизации проведена стимуляционная и игольчатая электромиография (ЭМГ) лицевой мускулатуры. Во всех случаях зарегистрировано полное отсутствие М-ответа с мимической мускулатуры лица. Выявлена также спонтанная активность в виде потенциалов фибрилляции различной степени выраженности как проявление острой денервации мимических мышц (рис. 1).

Для оценки результатов хирургического лечения проводились фото- и видеосъемка, фиксирующия состояние лицевой мускулатуры у всех пациентов на дооперационном и послеоперационном этапе. Пациенты из других регионов, которые не могли приехать в центр на осмотр, присылали фото- и видеоматериалы через 6 мес после операции.
Результаты
Оценка эффективности тригеминальной невротизации проведена у 17 (73,9%) пациентов (табл. 2), катамнез которых составил более 6 мес. Через 6 мес после операции у 16 (94,1%) пациентов наблюдалось восстановление функции ЛН до III-IV степени по шкале House-Brackmann. У 1 (5,9%) больного динамики восстановления функции ЛН не отмечено.

Развития ранних и поздних хирургических осложнений после вмешательства не отмечено, раны зажили первичным натяжением.
Пациент 54 лет (см. табл. 1, случай № 16) оперирован по поводу гигантской вестибулярной шванномы размером 53×42×38 мм. Во время удаления новообразования произошло анатомическое повреждение ЛН. В ходе вмешательства отмечено полное прекращение проводимости по нерву, по данным интраоперационного ЭМГ-мониторинга. Через 1 мес проведена стимуляционная и игольчатая ЭМГ лицевой мускулатуры (см. рис. 1, а), на которой выявлены признаки нейропатии ЛН с полным нарушением проведения импульса по нерву и грубой денервацией мимической мускулатуры.
Тригеминальная невротизация ЛН выполнена через 35 дней после удаления новообразования ЗЧЯ. На рис. 2 представлены паралич лицевой мускулатуры VI степени по HB до операции (см. рис. 2, а) и динамика восстановления через 4 мес (см. рис. 2, б) и 6 мес (см. рис. 2, в) в виде улучшения функции ЛН с VI до III степени по HB. По данным игольчатой ЭМГ, через 6 мес отмечена положительная динамика: появились признаки компенсаторной реиннервации мышц лица, более выраженные в круговой мышце рта (рис. 3).
Обсуждение
ЛН был первым нервом, на котором предпринята реиннервация с целью восстановления его функции. Этот вид вмешательства провел T. Drobnik в 1879 г. Операция заключалась в сшивании периферического отрезка ЛН с центральным отрезком двигательного нерва, где в качестве донора использовался добавочный нерв. Первым русским хирургом, осуществившим анастомоз ЛН, был В.М. Минц в 1903 г. В качестве нерва-донора он также использовал добавочный нерв [3, 5]. Вскоре для реиннервации ЛН, кроме добавочного, были использованы и другие черепные нервы: жевательный, диафрагмальный и подъязычный [3, 4, 6].
Несмотря на то что экстракраниальная реиннервация ЛН обеспечивает восстановление функции мимических мышц, она также обладает серьезными недостатками. При пересечении нерва-донора появляются дополнительные неврологические нарушения, которые снижают эффективность операций и в итоге не в полной мере удовлетворяют пациентов и хирургов [4, 6, 7].
Реиннервация ЛН диафрагмальным нервом была предложена в 1949 г. Ф.А. Поемным и Ф.Т. Хитровым. Перерезка диафрагмального нерва обычно не влечет за собой серьезных неврологических нарушений, но сопровождается трудно корригируемыми содружественными движениями, синхронными с дыханием [3, 5, 6].
Перерезка добавочного нерва, кроме атрофических изменений в трапециевидной и грудиноключично-сосцевидной мышцах и снижения силы в плече, также приводит к содружественным движениям лицевой мускулатуры, синхронным с движением руки, устранение которых требует длительного консервативного лечения, что не всегда устраивает пациентов [3, 4, 6].
По данным зарубежной литературы [1, 4, 6, 12-14], как альтернативный метод в настоящее время в качестве нерва-донора используют жевательный нерв. В работе B. Hontanilla и соавт. [14] описаны результаты исследования с участием 23 пациентов. В результате тригеминальной невротизации в 95% случаев в течение 6-18 мес было достигнуто улучшение функции ЛН до III-IV степени по шкале House-Brackmann. При сравнении эффективности реиннервации ЛН с подъязычным и жевательным нервами авторы показали, что результаты сопоставимы. Они отметили, что при реиннервации с жевательным нервом в более краткие сроки и с лучшим эффектом достигаются симметрия и появление движений [15].
По данным анализа русской и зарубежной литературы, исследователи склоняются к мнению, что при нарушении анатомической целостности ЛН лучшие результаты операций достигаются на более ранних сроках после поражения ЛН [6, 8, 14, 16]. При анатомической целостности ЛН, но функциональной его несостоятельности (VI степень по шкале House-Brackmann) и отсутствии спонтанного восстановления его функции через 6 мес сроки реиннервации составляют до 12 мес и определяются результатами игольчатой ЭМГ лица (наличие необратимого аксонально-демиелинизирующего процесса) [17, 18].


Также немаловажным преимуществом является то, что мышцы лица, иннервируемые ЛН, и мышцы, иннервируемые тройничным нервом, объединяет общее эмбриональное происхождение [17]. R. Collar и соавт. [13, 15] считают, что тройничный нерв идеален для реиннервации мимической мускулатуры, потому что лицевое ядро находится во взаимосвязи с мезенцефальным ядром тройничного моторного ядра и эти черепные нервы имеют центральные связи.
По данным авторов [12, 14, 15, 17], при использовании n. massetericus в качестве донора возникает меньше послеоперационных осложнений. У части пациентов утрачивается чувствительность мочки уха в периаурикулярной зоне [12, 13, 17]. Такого рода осложнения значительно меньше влияют на индекс качества жизни пациентов по сравнению с осложнениями, которые развиваются при использовании других нервов.
Заключение
Лечение повреждений ЛН является актуальной проблемой современной медицины, и до настоящего времени нет единой тактики ведения этих больных, которая позволила бы восстановить движения всех мимических мышц.
Более быстрое и эффективное восстановление функции мимической мускулатуры при анатомическом повреждении ЛН достигается проведением его реиннервации в оптимальные сроки не более 1 мес.
При анатомической целостности ЛН, но функциональной его несостоятельности (VI степень по шкале House-Brackmann), которая подтверждена данными игольчатой ЭМГ мимической мускулатуры, хирургический метод лечения следует применять в сроки от 6 до 12 мес.
Выбор методики всегда остается за хирургом, который должен руководствоваться не только возможностью ее технического выполнения, но и целесообразностью в каждом конкретном случае.
Комментарий
В.Н. Шиманский (Москва)
Комментарий
Нет никаких сомнений, что авторы использовали современную методику реиннервации лицевого нерва, однако при чтении статьи возникает определенная неудовлетворенность.
Нейрохирургия, как и кардиохирургия, относится к группе особо сложных специальностей, в которых качественные оценки результатов операций отличаются некоторым упрощением, так как на кону стоит жизнь пациента: останется он жив после операции с определенным улучшением или нет.
Выполнение анастомоза с жевательным нервом без комплексного последующего плана реабилитации, без одновременной «cross-plastic», которая является курковым механизмом для синхронности движений, обрывает возможности больных для последующих нейропластических операций, так как повторное хирургическое приближение к зоне анастомоза чревато его повреждением и аннулированием результата.
Значительно полезнее при крупных медицинских учреждениях создавать специальные группы подобных специалистов, которые будут профессионально заниматься этими «мелкими» проблемами. В течение 2 лет у нас существует такой тесный альянс с НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН и все пациенты с признаками повреждения лицевого нерва сразу направляются в ЦНИИС и ЧЛХ, где после комплексного обследования для них определяется индивидуальный и оптимальный метод хирургической реабилитации. В понятие «реабилитация» входят не только оперативные вмешательства, но и специальные упражнения, медикаментозное сопровождение, аппаратная стимуляция и т.д. Комплекс проводимых мероприятий позволяет добиться практически полного восстановления симметрии движений и даже в ряде удачных случаев, получить синхронный эффект моргания.
Считаю своим долгом поблагодарить авторов за желание улучшить качество жизни больных и советую принять во внимание высказанные замечания. Со своей стороны, мы будем рады подготовить специалиста по комплексному лечению поврежденного лицевого нерва.
Что такое нейропротезирование? Это вредно?
Что такое нейропротезирование? Это вредно?
Приходит время поздороваться с будущим: управляемые человеческим мозгом роботы уже начинают входить в нашу повседневную жизнь.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Раньше нам казалось, что протезы, управляемые нашим мозгом — это лишь плод воображения писателей и режиссеров фантастических фильмов, что это все будущее, и нам до него далеко. Но ведь это самое будущее уже наступает: благодаря развитию науки, в особенности нейробиологии и биоинженерии, многие люди, потерявшие конечности или парализованные, получили второй шанс. Шанс ощутить прикосновение любимого человека, шанс держать его за руку, шанс пройтись по улице, шанс видеть и слышать. Так что же такое нейропротезирование, как мозг может управлять протезом и как люди обретают второй шанс на нормальную жизнь?
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Помните Капитана Крюка, который имел протез кисти в виде крюка? Разнообразие протезов, начиная с древности и до современности, заставляет нас удивляться, насколько изобретателен человеческий разум, создавший, например, протез пальца египтянки, жившей 3000 лет назад [1], железную руку Берлихингена и т.д. Однако люди, потерявшие конечность, больше не могли чувствовать ею что-либо. Возможно, это было одной из причин, по которой люди отказывались от протезов. И вот на смену обычным протезам пришли более прогрессивные, которые могут управляться «силой мысли», которые стали более удобными в использовании и не доставляют дискомфорта. Наступила эра нейропротезов!
Этап первый: кохлеарные аппараты
Самый популярный и самый первый по времени разработки — кохлеарный имплантат. В 1748 году Бенджамин Уилсон использовал лейденскую банку, чтобы стимулировать слух у глухой женщины. В 1957 году два французских врача имплантировали во внутреннее ухо пациенту устройство, которое непосредственно стимулировало слуховой нерв. Вскоре после этого в 1961 году доктор Уильям Хаус разработал первый кохлеарный имплантат с одноканальными электродами. Затем в конце 1970-х были разработаны имплантаты с многоканальными электродами [2]. Использование многоканального электрода позволило создать более сложный и реалистичный сигнал, за счет стимуляции улитки.
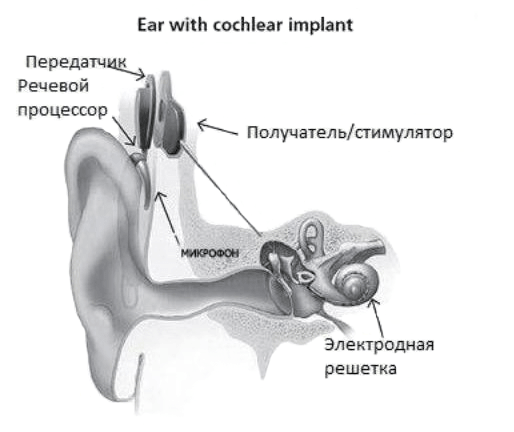
Имплантат состоит из внешней части, которая находится за ухом, и внутренней, которую хирургически помещают под кожу (рис. 1). Имплантат состоит из следующих устройств:
Рисунок 1. Схематическое изображение уха с кохлеарной имплантацией. Микрофон и речевой процессор (внешнее устройство) принимают звуковые сигналы от внешнего мира и передают информацию в приемник/стимулятор (внутреннее устройство), который соединен с электродной решеткой.
Имплантат не восстанавливает нормальный слух, зато помогает понять речь окружающих.
Кохлеарный аппарат сильно отличается от слухового аппарата тем, что слуховые аппараты усиливают звуки, чтобы их можно было обнаружить поврежденными ушами. Кохлеарные имплантаты обходят поврежденные участки уха и непосредственно стимулируют слуховой нерв. Сигналы, генерируемые имплантатом, отправляются через слуховой нерв в мозг, который распознает их как звук. Слух через кохлеарный имплантат отличается от обычного слуха и требует времени для изучения или переучивания. Благодаря имплантату люди могут понимать речь других людей и звуки окружающей среды.
Текущей областью исследования является разработка полностью имплантируемого устройства. Для воплощения этого в реальность нужно, чтобы микрофон был малым и очень чувствительным. Кроме того, аккумуляторная батарея должна иметь достаточно долгий срок службы и самозаряжаться, а вся система должна быть достаточно мала, чтобы полностью имплантироваться.
Этап второй: робо-руки и робо-ноги
Что такое интерфейс «мозг—компьютер»? Какие способы передачи сигналов существуют? Что такое неропротезирование? Это вредно? Предназначена ли протезная нога для каблуков?
Интерфейс «мозг—компьютер»
До недавнего времени мечта о возможности контролировать окружающую среду «силой мысли» была в области научной фантастики. Однако продвижение технологий принесло новую реальность: сегодня люди могут использовать электрические сигналы активности мозга, чтобы взаимодействовать с ними, влиять или изменять их среду. Технология интерфейса «мозг—компьютер» или нейрокомпьютерный интерфейс (НКИ) может позволить людям, неспособным говорить и/или использовать свои конечности, снова общаться или управлять вспомогательными устройствами для ходьбы и манипулирования объектами [3]. Пользователь и НКИ работают вместе. Пользователь после периода обучения начинает генерировать сигналы мозга, которые кодируют намерение, а НКИ, также после обучения, обнаруживает эти сигналы, декодирует и переводит их в команды на устройство вывода, которое выполняет намерение пользователя.
Что же такое нейропротезирование? Это вредно?
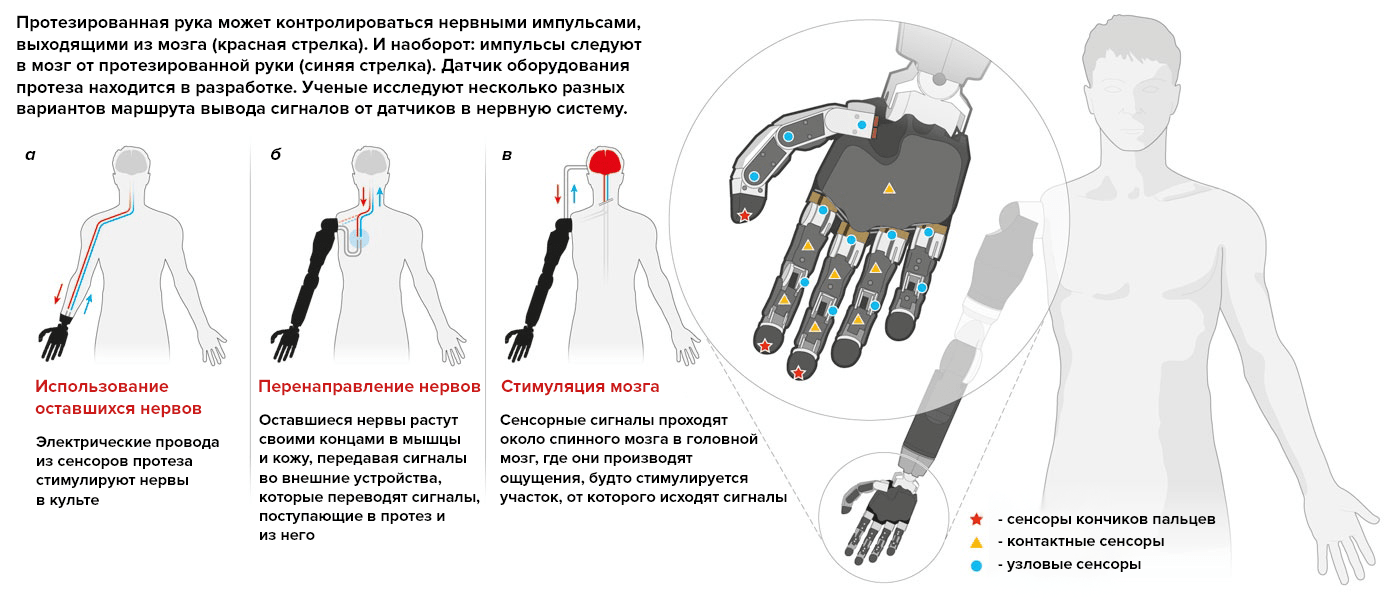
Нейропротезирование или нейронное протезирование — это область биомедицинской инженерии и нейробиологии, связанная с разработкой нейропротезов и их эксплуатацией. Систему впервые применили для замены сенсорной и двигательной функций. И ученые исследуют разные варианты доставки сигналов в нервную систему. На рисунке 2 изображены известные на данный момент способы [4].
Рисунок 2. Способы доставки сигналов от датчиков в нервную систему. Узловые сенсоры располагаются в местах сгибания механических пальцев. Контактные сенсоры — сенсоры, контактирующие с предметами. Чтобы увидеть рисунок в полном размере, нажмите на него.
Исследователи протезирования теперь пытаются предоставить протез, который будет чувствовать предметы не хуже настоящей руки, а возможно, даже лучше. Ведь такой протез может поднять предметы весом до 20 кг!
Способы доставки сигналов разделяются на электрическую стимуляцию нервов в культе (рис. 2а), перенаправление нервов на другие участки тела (например, на грудные мышцы) (рис. 2б) и прямое поступление импульсов в мозг и обратно (рис. 2в)
Что такое целевая реиннервация?
После ампутации конечности в организме остаются двигательные нервы, которые ее контролировали. Остатки нервов можно хирургическим путем перенести на маленький участок какой-нибудь крупной мышцы (это и называется реиннервацией). Например, к большой грудной мышце, если речь идет об ампутированной руке. В результате человек думает, что надо бы пошевелить пальцем. Мозг отправляет сигнал участку грудной мышцы, к которой присоединили нерв, шедший раньше к пальцам. Сигнал фиксируют электроды, которые отправляют импульс по проводам в процессор внутри роботической руки. Тут помогает электромиография. Эта технология позволяет регистрировать разность электрических потенциалов, возникающих при работе мышцы. Она улавливает движение реиннервированного участка грудной мышцы, после чего сигнал передается к нужной части протеза, и эта часть двигается.
Аналогичным образом осуществляется целевая сенсорная реиннервация. Она нужна для того, чтобы при помощи протеза человек мог чувствовать прикосновение, тепло или давление. Тут все в обратном порядке. Хирург перешивает уже оставшийся чувствительный нерв к участку кожи на груди. А сенсоры на протезе передают сигнал от прикосновения к этому самому кожному участку. И человек испытывает тактильные ощущения.
Первым пациентом, получившим эту «целевую реиннервацию», был Джесси Салливан, инженер-энергетик, который потерял обе руки из-за электрических ожогов. После того, как нервы рук были перенаправлены на его грудные мышцы, Салливан смог управлять протезными руками, просто думая о действиях (рис. 3). Но, к всеобщему удивлению, он также почувствовал, когда его груди коснулись. Будто бы коснулись его рук. Оказалось, что перенаправленные нервы вросли в кожу груди, и его мозг интерпретировал сенсорные сигналы в исходящие из его руки. Отдельные участки груди отвечали за касание ладони, другие же за касания пальцев и предплечья.
Рисунок 3. Джесси Салливан с нейропротезами.
Примером также может послужить Мелисса Лумис, проживающая в Кантоне, она потеряла руку в 2015 году. Ее покусал енот, и, хотя повреждения были не слишком сильными, инфекция, попавшая в рану, привела к сильному заражению. Очаг заражения находился в предплечье, которое пришлось ампутировать, поскольку под угрозой была жизнь пациентки. Женщине также сделали «целевую реинннервацию», только остатки нервов направили не на грудную мышцу, как было с Джесси, а в двуглавую мышцу плеча (видео).
«Я впервые чувствую предметы через протез», — говорит Мелисса.
Видео. Протез для Мелиссы.
А что, если связь нервов со спинным мозгом разорвана? Как тогда будут поступать сигналы в головной мозг от протеза?
Действительно, если разорвана связь со спинным мозгом вследствие травмы или заболевания, то методы перенаправления нервов или использование оставшихся нервов в культе не будут работать. Поэтому исследователи придумали другой изощренный подход: забраться в головной мозг (рис. 2в) и стимулировать определенный участок. Забраться в мозг не так уж и трудно, тем более что определенные участки мозга контролируют определенные части тела. Человеком, впервые испытавшим на себе такую методику, был 56-летний Билл Кочевар. Он оказался парализован в результате несчастного случая и смог пошевелить телом ниже плеч благодаря новой технологии имплантации.
Предназначена ли протезная нога для высоких каблуков?
Рисунок 4. Тестирование лодыжки.
Этап третий: бионический глаз — реальность или вымысел?
Со словами «бионический глаз» у нас ассоциируются самые разные вещи: у кого-то Терминатор, у кого-то Вселенная DC и комиксы, у кого-то высокие технологии протезирования, а у кого-то вообще нет никаких ассоциаций. Чем на самом деле является бионический глаз?
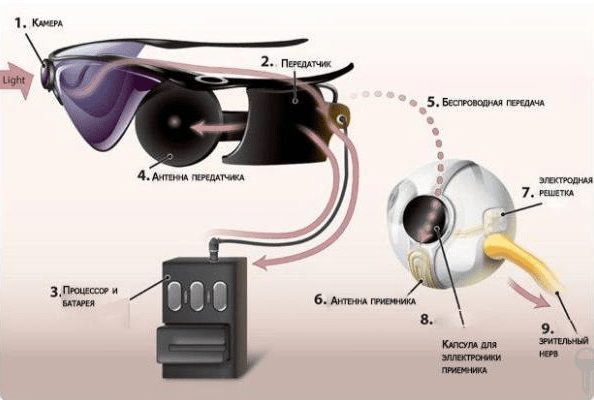
Рассмотрим рисунок 5.
Рисунок 5. Схема устройства Argus ll.
Миниатюрная камера, установленная на очках, используется для захвата изображения. Затем эти изображения анализирует портативный процессор и преобразует в электронный сигнал. Импульсы сигнала транслируются на имплантат по беспроводной сети через радиочастотные катушки. Полученный сигнал передается в электродную решетку, управляющую нервными элементами сетчатки (то есть биполярными и ганглиозными клетками) [6–8]. Именно здесь начинается обработка сигнала, и далее интегрируется, когда он проходит через зрительный нерв на зрительную кору для окончательного восприятия визуального изображения. Общая методика заключается в электрическом стимулировании зрительных путей с помощью протеза зрения или «бионического глаза». Суть стимуляции — в вызывании активности нейронов на участке, который остается функциональным независимо от основной причины слепоты.
Как мы остановим хакеров от вторжения в наши мозги, когда мы будем киборгами?
Стремительно развиваются взаимодействия между мозгом и компьютером. И эти технологии могут в конечном итоге превратить людей в настоящих киборгов. Однако до того как это случится, нам нужно удостовериться в безопасности нейронных устройств и защите их от хакерских угроз.
С мечтами о нашем светлом кибернетическом будущем исследователи опубликовали на портале Science свою работу Help, hope, and hype: ethical dimensions of neuroprosthetics [9]. Авторы поставили себе задачу не только описать те возможности, которые перед нами откроет сфера нейротехнологий, но и привелчь общественное внимание к тем опасностям, которые могут подстерегать нас на пути к этому сверхвысокотехнологичному будущему.
У всех таких технологий, к сожалению, есть и обратная сторона. Вокруг этой области начинают появляться серьезные этические вопросы, и поэтому самое время начать думать о том, каким образом нейропротезирование и сфера разработок мозг—машинных интерфейсов могут привести к злоупотреблениям в будущем, а также о том, как от этого защититься.
Уже сейчас мозг—машинные интерфейсы можно использовать для того, чтобы, управляя роботизированной рукой, схватить чашку или, смотря на экран компьютера, выбрать определенное слово в тексте. Но когда-нибудь такие устройства, только более продвинутые, будут использоваться как аварийным работником для ликвидации опасной утечки газа, так и мамой ребенка, у которой не хватает лишних рук, чтобы успокоить своего плачущего малыша. Что, если в этой ситуации что-то пойдет не так, например, робот-нянька случайно выронит ребенка? Важно задать себе вопрос: где начинается и заканчивается зона ответственности, и кто в таких случаях должен быть признан виновным? Была это ваша оплошность по невнимательности или ошибка робота? Как сравнить ответственность человека с нейропротезом и человека, случайно совершившего тот же проступок своими руками? Лежит ли ответственность за такие сбои на производителях? Или на ученых? Доверяя ребенка роботу, осознавали ли вы, что устройство может выйти из строя? Юридической системе будущего придется определять, находится ли нарушение в зоне ответственности производителя роботизированного изделия (в конструкции найден брак или программная ошибка) или пользователя (неправильное использование или внешнее неавторизованное воздействие на целостность конструкции).
Для минимизации таких потенциальных проблем авторы обсуждаемой работы предлагают, чтобы любая полуавтономная система оснащалась функцией автоматической блокировки, и в случае ненадлежащего или незапланированного использования эта функция активировалась в обход прямого канала взаимодействия «мозг—компьютер». Если искусственная конечность начнет выполнять действия, которые пользователь не подразумевал для выполнения, то такой «выключатель» сможет самостоятельно принять решение по мгновенной деактивации системы, предотвратив потенциальную беду.
Еще одним аспектом, беспокоящим исследователей, является безопасность частной жизни пользователя и необходимость в защите любой личной информации, которая будет записываться подобными системами. Весьма вероятно, что системы, базирующиеся на интерфейсе «мозг—компьютер», будут собирать самую различную информацию о неврологическом статусе пользователя, после чего она будет передаваться на компьютер. Естественно, что такая схема не может не вызывать некоторые опасения по поводу защиты конфиденциальных данных. По мнению исследователей, собираемая информация может быть украдена и использована ненадлежащим образом.
Еще сильнее исследователей беспокоит возможность цифрового взлома злоумышленниками подключенного к мозгу устройства, что может фактически поставить под угрозу жизнь пользователя этого устройства. С помощью так называемого «взлома мозга» могут производиться злонамеренные манипуляции с мозговыми имплантатами. Хакеры смогут получить контроль над движениями роботизированных конечностей человека.
Возможное решение этой проблемы будет включать повышенный уровень шифровки информации, создание надежной сетевой безопасности и открытого коммуникационного канала между производителем изделия и его пользователем. Настает время задуматься над путями, которые позволят всем выработать стандарты по разработке необходимых защитных мер.
В перспективе неинвазивные интерфейсы «мозг—компьютер» можно будет использовать для создания своего рода телекинетической связи с окружающим миром, в котором мы своими мыслями сможем управлять освещением в доме или хотя бы просто переключать телеканалы. Другими словами, дальнейший прогресс будет способен превратить эти технологии в технологический вид телепатии. Что же касается исследователей, то их ключевой посыл заключается в том, чтобы мы были готовы к этому и смогли предотвратить использование подобных технологий в злонамеренных целях.
Заключение
Нейропротезирование — глобальная тема для будущего. Технологии становятся реальностью благодаря усердному труду ученых. Возможно, в будущем ученые разработают когнитивные имплантаты, делая нас более умными и сильными. Станем ли мы киберобществом [10]?