Репарация тканей что это
Насколько фатальны для легких последствия коронавируса и есть ли шанс их восстановить: отвечает профессор-пульмонолог
А также у кого повышенный риск развития фиброза, пояснил один из ведущих экспертов по COVID-19, доктор медицинских наук Кирилл Зыков.
ЧТО ЗНАЧАТ ДИАГНОЗЫ «ПНЕВМОСКЛЕРОЗ» И «ПНЕВМОФИБРОЗ»
При этом нужно помнить, что возможности наших легких очень значительны. И если после перенесенного заболевания, в том числе COVID-19, есть какой-то локальный пневмосклероз, относительно небольшие изменения, это не влияет на функциональные возможности легких. То есть человек попросту не почувствует каких-то неприятных последствий.
— Можно ли назвать процент или примерный масштаб повреждения легких, при которых такие последствия уже будут ощутимы?
— В ситуации с COVID-19 обнаружилась поразительная особенность: клиническое состояние, ощущения самого пациента могут не совпадать со степенью повреждения легких на КТ (компьютерной томографии) и по лабораторным данным. Этот одна из загадок новой инфекции. Порой возникает ощущение, что эти параметры живут своей жизнью, независимо друг от друга. Иногда мы видим, что у пациента на КТ поврежден достаточно большой объем легких, а человек уверяет, что чувствует себя нормально. И есть обратная ситуация, когда у больного выраженная одышка, высокая температура, а изменения на КТ довольно незначительны. Эту тайну коронавируса еще предстоит раскрыть.
ЧЕМ ДОЛЬШЕ ТЕЧЕНИЕ БОЛЕЗНИ, ТЕМ БОЛЬШЕ ФИБРОЗНЫЕ ИЗМЕНЕНИЯ
— От врачей сейчас часто можно услышать: о коронавирусной инфекции мы пока знаем мало, и непонятно, что дальше будет с легкими у переболевших.
— На самом деле сейчас мы можем ориентироваться на опыт предыдущих вспышек коронавирусов — SARS, или атипичной пневмонии, в 2002 — 2003 гг. и MERS, или Ближневосточного респираторного синдрома, в 2012 — 2013 гг. Срок наблюдения за пациентами, перенесшими эти виды коронавирусной инфекции, уже достаточно большой. В то время как срок нашего знакомства с COVID-19 всего около полугода.
Поэтому мы можем экстраполировать, то есть переносить данные предыдущих наблюдений на нынешнюю ситуацию. Если говорить об оценках последствий и конкретных цифрах, то большую роль играет тяжесть состояния, в котором госпитализировались пациенты. От этого зачастую зависят и шансы выжить, и частота и масштаб фиброзных изменений в легких. По разным данным, у пациентов с SARS такие изменения в легких встречались в 10 — 20% случаев (как раз в зависимости от тяжести состояния).
— И как долго сохранялись фиброзные изменения в легких?
— Есть наблюдения, что у части пациентов неблагоприятные изменения сохранялись через 9 месяцев после выписки из госпиталя. При этом выраженность фиброза зависела от длительности заболевания и его лечения. Чем дольше течение болезни, тем выше вероятность того, что у человека будут фиброзные изменения.
В ТЕМУ
У кого чаще развивается фиброз легких:
— Люди старшего возраста (65+)
— Люди с генетической предрасположенностью к развитию фиброза (если этим страдали родители или один из них, бабушки, дедушки)
— Пациенты с системными воспалительными заболеваниями соединительной ткани (системная красная волчанка, склеродермия, болезнь Шегрена и другие)
Чем больше уровень повреждений на КТ, тем выше вероятность того, что разовьются фиброзные изменения. Для тех, кто интересуется, упрощенно можно представить себе это процесс так: при «Ковиде» повреждается альвеолярный эпителий (оболочка альвеол, пузырьков в легких), резко возрастает воспалительный ответ. Как защитная реакция организма, в том числе, активируются клетки-фибробласты, формируется коллаген, и это является основной фиброза в дальнейшем
РЕШАЮЩИЙ СРОК — ПЕРВЫЙ ГОД
— После года подвижек в положительную сторону уже не было.
— Но ведь считается, что фиброз необратим? Переродившуюся ткань как легких, так и любого другого органа, в клинической практике еще вроде бы не научились превращать снова в полноценно работающие клетки?
-Так что на практике переболевшим остается ждать в течение года, чтобы понять масштаб «настоящего» фиброза и надеяться, что часть изменений пройдет, так?
— Главное, в течение этого года не усугубить ситуацию, не ухудшить состояние легких, а также принимать меры для восстановления и реабилитации.
Часовые генома
Эта история началась как в персидской поэме-сказке «Восемь райских садов» Амира Хосрова Дехлеви, написанной еще в XIV в. Жили некогда три брата-принца на острове Цейлон, именуемом тогда Серендипом. И была у них особенность – когда они что-то искали, то находили совершенно другое, но при этом еще более нужное. Почти пять столетий спустя это сказание прочел английский писатель Г. Уолпол и придумал слово serendipity. Считается, что оно входит в список десяти английских слов, самых трудных для перевода, но суть его понятна из легенды – это способность делать неожиданные удачные открытия «по случаю». Неудивительно, что именно в научном мире слово это употребляется особенно часто.
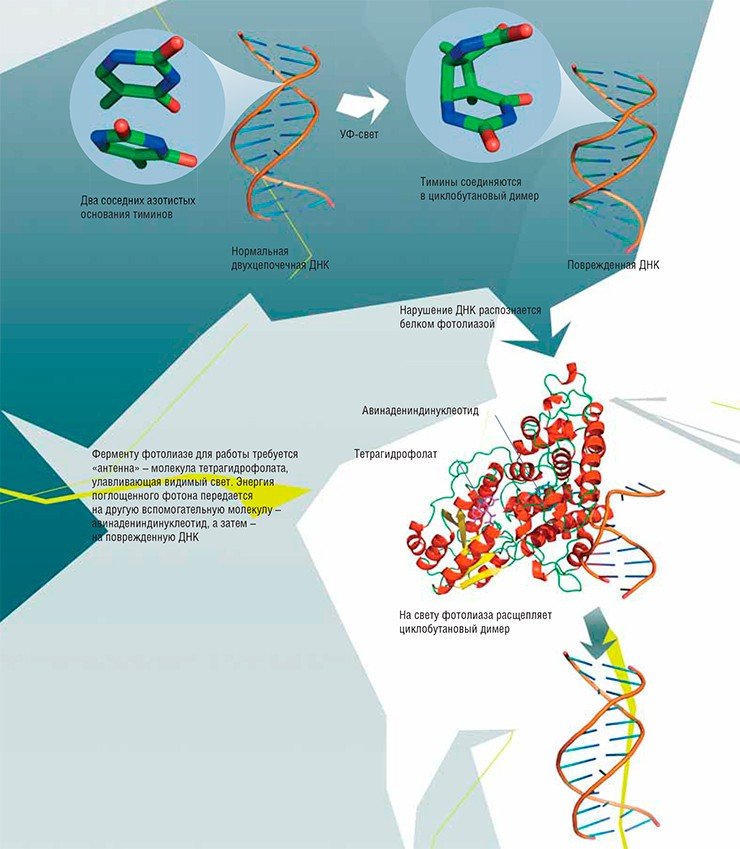
Вот так «по-серендипски» все и произошло… В 1946 г. А. Кельнер из знаменитой лаборатории молекулярной биологии в Колд-Спринг-Харборе занимался важным делом – искал новые антибиотики. Дело было сразу после войны, и успех пенициллина был у всех на слуху. Работая с бактериями стрептомицетами, Кельнер решил проверить, можно ли каким-то стрессовым воздействием заставить их вырабатывать больше нужного продукта. В качестве стрессового фактора он использовал облучение ультрафиолетом. Но вот беда – ему никак не удавалось подобрать нужную дозу облучения, при которой бактерии выживали. Данные по выживаемости стрептомицетов, оцененной по росту их колоний, «скакали» в зависимости от условий, в которых они находились после облучения.
К счастью, будучи очень аккуратным, Кельнер скрупулезно записывал мельчайшие детали своих экспериментов. Оказалось, что сразу после облучения выживаемость стрептомицетов была низкой. Ситуация не особенно улучшалась, если их затем держали какое-то время в темноте. А вот на свету выживаемость постепенно увеличивалась, и чем больше света – тем быстрее!
Перепроверка всех результатов заняла у Кельнера три года. А тем временем инактивацию ультрафиолетом бактериофагов (вирусов бактерий) изучал Р. Дульбекко, будущий нобелевский лауреат (в то время он был молодым научным сотрудником в группе С. Лурии, тоже будущего нобелевского лауреата). Ученый пришел точно к таким же выводам, как и Кельнер.
Удивительное совпадение: когда Кельнер написал статью о своих результатах, он послал ее именно Лурии для прочтения и критики. К чести Дульбекко и Лурии, они не стали зажимать работу конкурента, а, напротив, поделились с ним своими достижениями. Статьи обоих ученых вышли в одно и то же время. В общем-то, уже тогда было известно, что ультрафиолет повреждает генетический материал клетки. Результаты исследований свидетельствовали, что видимый свет помогает ему восстанавливаться. Этот процесс назвали фотореактивацией.
Вот так, совершенно случайно и «попутно» было сделано открытие процесса репарации ДНК, не менее важного, чем широко известные другие молекулярно-генетические процессы репликации, транскрипции и трансляции генетического материала. История принцев Серендипа в очередной раз повторилась.
Зачем это нужно?
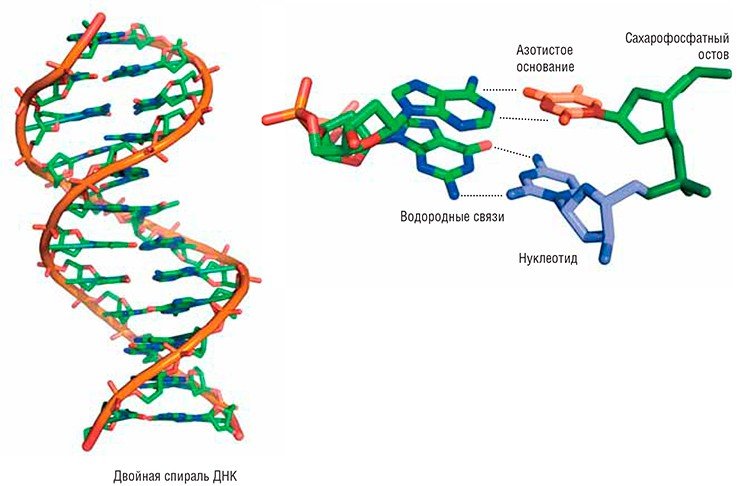
Как известно, ДНК состоит из азотистых оснований четырех разных типов и сахарофосфатного остова, образующего непрерывную цепочку, на которую эти основания навешены. Повреждаться могут как основания, так и остов. Всего насчитывают около сотни возможных различных повреждений, механизмы возникновения которых также различаются.
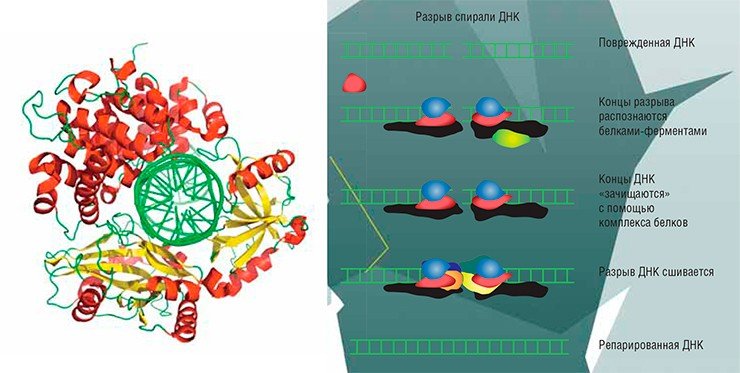
Например, при дезаминировании (отщеплении аминогруппы NH2) из обычного для ДНК основания цитозина возникает урацил, в норме встречающийся только в РНК. Основания ДНК могут подвергаться окислению. К некоторым позициям в основаниях охотно присоединяются другие углеродсодержащие группы – происходит алкилирование. Под влиянием ультрафиолетового света соседние тимины могут сшиваться друг с другом, образуя димеры. Очень часто основания отрываются от остова ДНК: так возникают АП-сайты. А ионизирующая радиация приводит к появлению в цепи ДНК одно- или двухцепочечных разрывов.
Повреждения ДНК, особенно если их много, могут вызывать не только мутации, но и гибель клетки. Тут необходимо отметить, что повреждение ДНК и мутация – не одно и то же. Чтобы повреждение превратилось в мутацию, нужно, чтобы произошла репликация – синтез новой цепочки ДНК на матрице «старой». Обычно при репликации соблюдается принцип комплементарности. Однако если в матрице есть поврежденное звено, то напротив него в дочернюю цепь включится совсем не то, что нужно.
Например, напротив АП-сайта может включиться в принципе все, что угодно – ведь на матрице нет основания-подсказки. Вот так и возникнет мутация, т. е. отклонение последовательности ДНК от исходной. Мутации в половых клетках передаются следующему поколению, а в остальных клетках организма могут приводить к раку. Как полагают сейчас многие ученые, и самая неизлечимая «болезнь» – старение – тоже тесно связана с накоплением мутаций в клетках нашего тела.
Кстати сказать, еще одним источником появления ошибок в ДНК служит неправильное включение нуклеотидов при самой репликации. Ферменты ДНК-полимеразы делают такие ошибки с частотой примерно 0,001—0,00001. Частично полимеразы могут сами исправлять свои ошибки, сразу вырезая неправильно включенное звено, что повышает их надежность еще в 100—1000 раз. Однако даже такая точность соответствует десяткам или даже сотням ошибок, которые возникают в каждой нашей клетке при ее делении.
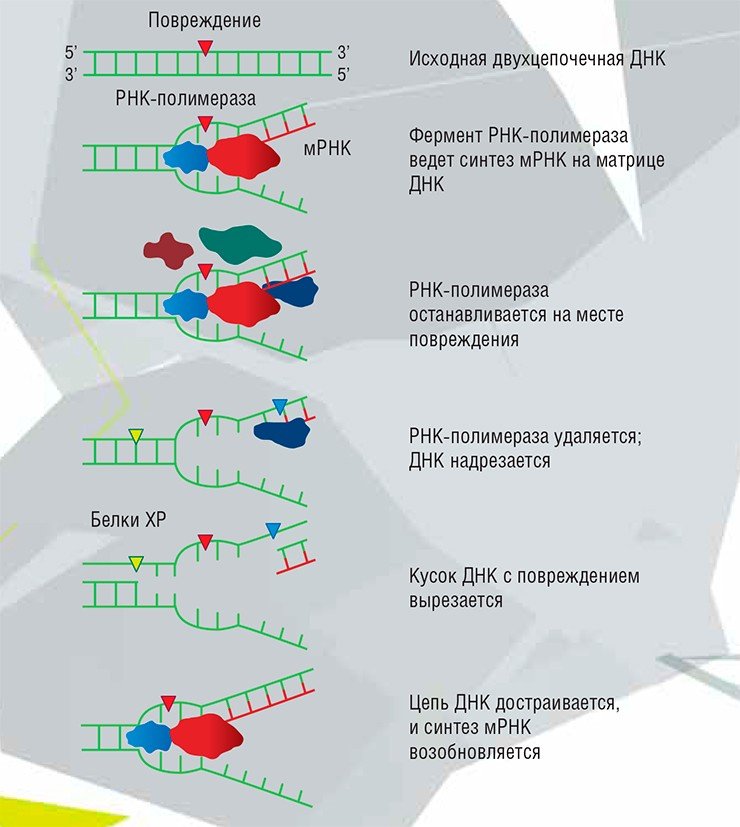
Все ошибки, возникшие в нуклеотидной последовательности ДНК, необходимо исправлять. Поэтому в процессе эволюции возникли несколько систем, известных под общим названием «системы репарации ДНК», защищающие нас от мутаций, вызванных повреждениями наследственного материала. Дать их даже очень схематичное описание в небольшой статье – задача практически невыполнимая. А полное их описание в главном талмуде ученых-репарационщиков – книге Э. Фридберга «Мутагенез и репарация ДНК» (2006 г.) – занимает полторы тысячи страниц убористого текста. Тем не менее получить общее представление о работе этих систем вполне возможно.
Врачу, исцелися сам!
При штатной работе систем репарации наш геном вполне стабилен. Однако, как и в любой достаточно сложной схеме, у них есть свои слабые точки, неполадки в которых приводят к сбою всего механизма.
Гены, кодирующие белки репарации, ничем не отличаются от других генов – в них тоже могут происходить мутации. Если такая мутация не позволяет белку нормально функционировать, соответствующий путь репарации отключается. Тогда в организме проявляется так называемый мутаторный фенотип, в котором новые мутации появляются гораздо легче, со всеми вытекающими отсюда неприятными последствиями. Дефекты определенных генов репарации проявляются как наследственные болезни, для которых обычно повышен риск возникновения рака, но вообще их проявления могут быть достаточно разнообразны.
РЕМОНТНАЯ МАСТЕРСКАЯ ДНК: УЧИМ МАТЧАСТЬ
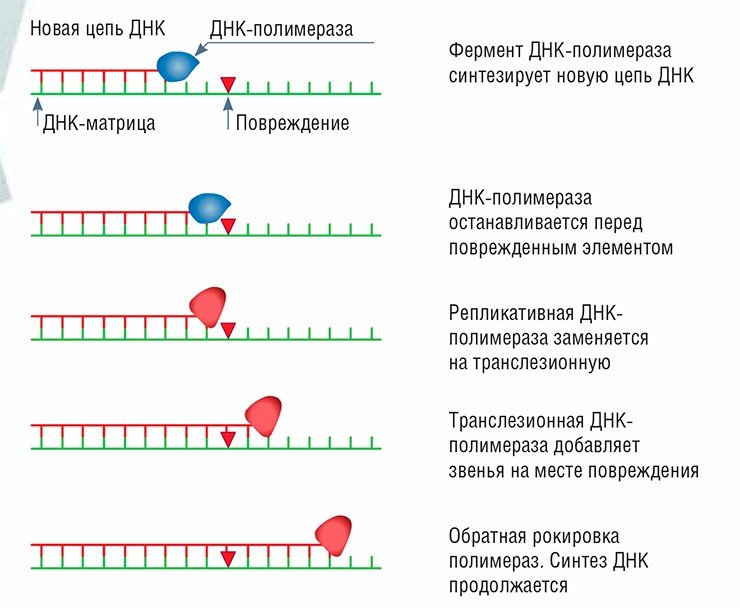
Пожалуй, самая известная и хорошо изученная из таких болезней – пигментная ксеродерма. Она даже оставила следы в художественной литературе: любители триллеров Д. Кунца могут вспомнить, что именно ей страдает детектив-любитель Кристофер Сноу, главный герой цикла «Лунная бухта». На самом деле это даже не одно заболевание, а целых восемь, но с довольно схожими проявлениями. Большая часть случаев связана с неисправностями системы эксцизионной репарации нуклеотидов (недостатком любого из семи белков XPA–XPG, в ней участвующих) либо белка XPV, который представляет собой ДНК-полимеразу, участвующую в транслезионном синтезе.
Фотографиями людей, больных пигментной ксеродермой, специалисты по репарации любят пугать аудиторию на лекциях или научных конференциях. Главный признак болезни – тяжелые ожоги, остающиеся на коже после самого непродолжительного пребывания на солнце. После ожогов быстро появляются пигментные пятна, кожа сохнет и растрескивается, а кончается все раком кожи, который развивается примерно к 7—8 годам. Поражаются и глаза, которые очень болезненно реагируют на солнечный свет. Менее половины больных пигментной ксеродермой доживают до 20 лет. Хорошо, что болезнь эта встречается довольно редко: среди европейцев – примерно у 4 человек из миллиона. А вот у японцев частота встречаемости пигментной ксеродермы в шесть раз выше.
Внимание ученых эта болезнь привлекает в том числе и своей многоликостью. Нечасто бывает, что повреждение одного и того же гена вызывает разные заболевания, но в данном случае дела обстоят именно так. Причина в том, что один и тот же белок может входить в состав разных белковых комплексов, выполняющих в клетке разные функции. И одна мутация может нарушать только способность белка работать в одних комплексах, в других же он будет вполне работоспособен.
Например, некоторые мутации в гене, кодирующем репарационный белок XPD, вызывают типичную ксеродерму, а другие мутации в том же гене – совершенно другую болезнь, синдром Кокейн, при которой в первые два года жизни начинаются проблемы с ростом и развитием. В результате у таких детей развивается карликовость и истощение, а лицо приобретает характерную «птичью» форму – ввалившиеся глаза и выдающийся нос. Разрушаются оболочки нервных волокон, многие нейроны отмирают, в сосудах головного мозга откладываются соли кальция – создается впечатление, что нервная система при этом синдроме стареет намного быстрее остального организма. Средняя продолжительность жизни таких больных еще меньше – около 12 лет.
А еще мутация в том же самом гене может вызывать и третью болезнь – трихотиодистрофию, при которой репарация ДНК происходит практически нормально, но при этом в организме нарушается синтез некоторых белков-кератинов. Результат – ломкие волосы, чешуйчатая кожа и почти полное отсутствие жировой ткани на лице.
Всего насчитывают несколько десятков наследственных заболеваний, связанных с неисправностями систем репарации. По большей части такие болезни, как и следовало ожидать для мутаторного фенотипа, отличаются повышенным риском развития рака и зачастую – ускоренным старением.
В частности, синдром Вернера, при котором не работает одна из ферментов-геликаз репарации, практически точно воспроизводит картину нормального старения. Вот только обычный срок человеческой жизни при этом сжат до 30—50 лет… А еще дефекты репарации часто проявляются в нейродегенеративных заболеваниях. Все знают, что «нервные клетки не восстанавливаются», и хотя это на самом деле не совсем так, но все же типичный нейрон действительно должен служить человеку всю жизнь. А за это время в его ДНК возникает множество повреждений.
Крем с ферментами
Разумеется, такие мощные и специфичные защитные средства, как ферменты репарации, не могли пройти мимо внимания медиков. Хорошо было бы научиться использовать их для предохранения нашего генома от повреждений! Теоретически это возможно, но есть огромная проблема: пока что никто не придумал способа, с помощью которого молекулы белка, используемые в качестве лекарства, могли бы проникать во все клетки тела. Более того, белки вообще плохо проникают в клетки – для этого приходится использовать всяческие ухищрения. Например, их можно запаковать в специальные мембранные пузырьки – липосомы, которые будут сливаться с клеточными мембранами и высвобождать свое содержимое внутрь клетки.
Однако этим способом пока можно доставить терапевтические ферменты не во все ткани, а лишь в такие легкодоступные места, как кожа. Тут ферменты репарации действительно уже нашли применение в медицине – ведь кожа, частенько находящаяся под действием солнечного света, принадлежит к числу органов, больше всего страдающих от генотоксического стресса.
Американская компания AGI Dermatics выпускает кремы с липосомами, содержащими фотолиазу и эндонуклеазу V – два фермента, участвующие в репарации циклобутановых димеров, образующихся в ДНК под действием ультрафиолета. Небольшая баночка крема стоит около сотни долларов, и, по уверениям фирмы, ее продукт работает гораздо лучше обычных защитных кремов. Возможно, это действительно так: в отличие от большинства косметических продуктов, которые никогда не проходили жесткого тестирования, обязательного для лекарств, липосомы AGI Dermatics сейчас находятся на последней стадии клинических испытаний по профилактике рака кожи, в том числе и у больных пигментной ксеродермой.
По-видимому, использование ферментов репарации для предохранения барьерных тканей (кожи и слизистых оболочек) от генотоксического стресса имеет большое будущее. Уже сейчас ДНК-гликозилазы, исправляющие окислительные повреждения ДНК, испытываются (пока на животных) в качестве средств для предупреждения рака легких – органа, подвергающегося самой массированной атаке кислородными радикалами.
Репарацию у врага – подавить!
Итак, если у нас работают системы репарации – это хорошо. Плохо, когда они работают у наших врагов – болезнетворнх бактерий, вирусов и опухолевых клеток. Можно ли каким-то образом на них воздействовать, подавив в них репарацию? Такие примеры уже имеются.
Проще всего, как ни странно, оказалось использовать системы репарации в качестве мишени для лекарств при онкологических заболеваниях. Как известно, очень многие химиопрепараты действуют, повреждая ДНК раковой клетки. При этом эти повреждения, разумеется, подвергаются репарации, что снижает эффективность действия лекарств. Поэтому ингибирование репарации рассматривается сейчас как перспективный метод усиления действенности химиотерапии. Например, на последней стадии клинических испытаний находится бензилгуанин – ингибитор фермента-самоубийцы MGMT, который «ремонтирует» алкилированные основания ДНК и тем самым мешает работе таких широко применяемых противоопухолевых агентов, как кармустин и темозоломид.
Ингибиторы репарации для борьбы с бактериями и вирусами существуют пока только в проекте. Однако известно, что некоторые вирусы, например поксвирусы (в том числе вирус натуральной оспы), герпесвирусы (вирусы простого герпеса и ветряной оспы) и лентивирусы (ВИЧ), нуждаются для своего размножения в репарационном ферменте урацил-ДНК-гликозилазе, либо собственной, либо заимствованной у хозяина. Ингибиторы этого фермента также уже испытываются как противовирусные лекарства.
ДНК, как здоровье?
То, что повреждение ДНК может доставить массу неприятностей – понятно. А есть ли способ как-то оценить «здоровье» ДНК, померить, сколько в ней «ошибок»? Это очень важно, например, для оценки потенциальной степени мутагенности окружающей среды, влияния нового лекарства на человеческий организм, да мало ли еще для чего…
Один такой способ изобрел в 1988 г. Нарендра Сингх из американского Национального института старения. Речь идет о кометографии, или методе кометного хвоста. В самом простом варианте при этом измеряется число двухцепочечных разрывов в ДНК. Отдельные клетки (например, лейкоциты крови) заплавляют в агарозную плашку, разрушают их оболочку особыми реагентами и помещают в электрическое поле – ведут знакомый всем биохимикам электрофорез. Молекула ДНК, заряженная отрицательно, движется к аноду. Но так как она очень длинная, то с места почти не сдвигается. Но если в ДНК есть разрывы, то более короткие фрагменты быстро «убегают», за ними тянутся более длинные и т. д. Так что если окрасить ДНК специальными красителями, то будет видна характерная фигура – «кометный хвост». Чем хвост длиннее, тем больше в ДНК коротких фрагментов, тем больше разрывов и тем сильнее она повреждена.
С момента изобретения кометографии придумали множество ее разновидностей для обнаружения разных видов повреждений. Например, если вести электрофорез в щелочных условиях, то двойная спираль ДНК разделяется на отдельные цепочки. В результате можно увидеть не только двухцепочечные, но и одноцепочечные разрывы и даже АП-сайты. А если всю плашку предварительно хорошенько замочить в растворе, содержащем какую-нибудь ДНК-гликозилазу, то можно будет установить, сколько в ДНК было поврежденных оснований, которые этот фермент вырезает.
Помимо совершенствования методов кометографии постоянно ищутся и новые объекты. Например, несколько лет назад немецкие исследователи предложили для оценки состояния природных водоемов проводить кометографию на пресноводных губках, которые легко «разобрать» на отдельные клетки. Немцы даже приезжали на Байкал, собрали там губки и удостоверились, что байкальская вода генам на пользу.
Легко и быстро оценивать генотоксичность внешней среды помогает система, основанная на SOS-ответе бактерий. Известно, что некоторые бактериальные гены, в том числе гены репарации, включаются только при повреждении ДНК. В начале всех таких генов есть специальный регуляторный элемент – SOS-бокс. Если под него вместо штатного гена подставить какой-нибудь репортерный элемент (например, ген, кодирующий излюбленный биохимиками зеленый флуоресцентный белок), то в условиях, повреждающих ДНК, бактерия будет давать соответствующий цветной сигнал. Таким образом, светящиеся бактерии будут свидетельствовать об опасности для человеческих генов.
Сегодня насчитывается несколько десятков конструкций подобных биосенсоров – некоторые посылали даже в космос для исследования повреждающего действия космических лучей.
Практически закончив писать эту статью, автор зашел в базу данных PubMed, где собраны аннотации почти всех статей по биомедицинской тематике, когда-либо выходивших в мире.
Беглый поиск выдал 33 646 публикаций по тематике «репарация ДНК». Почти все новые «горячие» направления в биологии так или иначе пересекаются с репарацией – есть работы и по репарации в стволовых клетках, и по генотоксичности наночастиц… Как видно, интерес к этой теме огромен, и он будет только расти, ведь безопасность личного генома волнует нас всех.
И, будем надеяться, чудесная особенность принцев Серендипа, с которой началась история открытия репарации ДНК, еще не раз послужит ученым, работающим в этой области.
Жарков Д. О. Загадки «ржавой» ДНК // Наука из первых рук. – 2006. –№ 6. – С. 24—35.
Ходырева С. Н., Лаврик О. И. Как клетка ремонтирует ДНК // Наука из первых рук. – 2007. –№ 3. – С. 82—89.
Автор и редакция благодарят К. Баумштарк-Хан (Институт аэрокосмической биологии, Германия) за помощь в подготовке иллюстраций
Осложнения ран. Основные принципы лечения
Ранения могут сопровождаться разнообразными осложнениями, как сразу после нанесения ран, так и в отдаленные сроки. К осложнениям ран относятся:
· Развитие травматического или геморрагического шока – является наиболее ранним и грозным осложнением. В отсутствие немедленной помощи становится причиной неблагоприятного исхода.
· Серомы – скопления раневого экссудата в раневых полостях, опасные возможностью нагноения. При развитии серомы необходимо обеспечить эвакуацию жидкости из раны.
· Раневые гематомы – образуются вследствие неполной остановки кровотечения. Гематомы являются потенциальными очагами инфекции, кроме того, сдавливая окружающие ткани, приводят к их ишемии. Их необходимо удалять с помощью пункции или при ревизии раны.
· Некрозы окружающих тканей – развиваются при нарушении кровоснабжения в соответствующей области при травматизации тканей во время операции или неправильном наложении швов. Влажные некрозы кожи необходимо удалять из-за опасности появления глубоких скоплений гноя. Поверхностные сухие некрозы кожи не удаляют, так как они выполняют защитную функцию.
· Раневая инфекция – ее развитию способствуют высокий уровень контаминации и высокая вирулентность попавшей в рану микрофлоры, наличие в ране инородных тел, некрозов, скоплений жидкости или крови, повреждение при ранении костей, нервов, сосудов, хроническое нарушение местного кровоснабжения, а также поздняя хирургическая обработка и общие факторы, влияющие на течение раневого процесса. В экспериментальных и клинических исследованиях установлено, что в большинстве случаев для развития инфекционного процесса в ране необходимо, чтобы ее контаминация превысила критический уровень, составляющий 105-106 микроорганизмов на 1 грамм ткани. Среди общих факторов, способствующих развитию раневой инфекции, важную роль играет значительная кровопотеря, развитие травматического шока, предшествующее голодание, авитаминозы, переутомление, наличие сахарного диабета и некоторых других хронических заболеваний.
При попадании в рану с землей, пылью, инородными телами Cl. Tetani возможно развитие столбняка. В отсутствие специфической профилактики вероятность заболевания столбняком при наличии контаминированных ран достигает 0, 8%. Через укушенные раны в организм может проникать вирус бешенства.
· Осложнения рубцов – образование гипертрофированных рубцов и келоидов. Гипертрофированные рубцы развиваются при склонности к избыточному образованию рубцовой ткани и чаще всего при расположении раны перпендикулярно к линии Лангера. Келоиды в отличие от гипертрофированных рубцов имеют особую структуру и распространяются за пределы границ раны. Осложнения рубцов ведут не только к косметическим, но и к функциональным дефектам, таким как нарушение ходьбы или функций верхней конечности из-за ограничения объема движений в суставах. Хирургическая коррекция показана при гипертрофированных рубцах с нарушением функции, однако при келоидах она нередко приводит к ухудшению результата лечения.
· Длительно существующие хронические раны могут осложниться развитием малигнизации. Диагноз подтверждает биопсия тканей раны. Лечение оперативное – необходимо радикальное иссечение в пределах здоровых тканей.
Основные принципы лечения ран
Лечение при ранениях обычно проходит в два этапа – этап первой помощи и этап квалифицированной помощи.
¨ Этап первой помощи
При оказании первой помощи на месте ранения решаются две основные задачи: остановка кровотечения и предотвращение дальнейшей микробной контаминации. Первая помощь включает в себя применение доступных методов временной остановки кровотечений, обезболивание, наложение защитной повязки и транспортную иммобилизацию. На этом этапе не следует промывать рану и удалять из нее инородные тела.
¨ Этап квалифицированной помощи
На этапе госпитальной помощи решаются следующие задачи:
· профилактика и лечение раневых осложнений;
· ускорение процесса заживления;
· восстановление функций поврежденных органов и тканей.
Основные принципы лечения ран:
· строгое соблюдение асептики на всех этапах лечения;
· обязательная хирургическая обработка;
· активное дренирование;
· максимально раннее закрытие ран первичными или вторичными швами или с помощью аутодермопластики;
· целенаправленная антибактериальная и иммуннотерапия, коррекция системных нарушений.
Для выбора адекватной тактики лечения ран необходима тщательная оценка ее состояния, при этом оцениваются:
· Локализация, размер, глубина раны, повреждения нижележащих структур, таких как фасции, мышцы, сухожилия, кости.
· Состояние краев, стенок и дна раны, а также окружающих тканей, наличие и характеристика некротических тканей.
· Время, прошедшее с момента ранения.
¨ Лечение контаминированных ран
Риск развития раневых осложнений при наличии контаминированных ран гораздо выше, чем при асептических ранах. Лечение контаминированных ран состоит из следующих этапов:
В целях профилактики столбняка вакцинированным пациентам вводят 0, 5 мл столбнячного адсорбированного анатоксина, невакцинированным пациентам – 1 мл анатоксина и 3000 МЕ противостолбнячной сыворотки. Из-за опасности развития анафилактических реакций на белок введение противостолбнячной сыворотки производится по Безредко: сначала 0, 1 мл разбавленной сыворотки вводится внутрикожно, при величине папулы менее 10 мм через 20 минут вводится 0, 1 мл неразведенной сыворотки подкожно, и только при отсутствии реакции на подкожное введение через 30 минут вводится вся доза подкожно.
При укусах животных (собак, лис, волков и др. ), подозрительных на бешенство, или попадании их слюны на поврежденные ткани нельзя производить первичную хирургическую обработку раны. Рана только промывается и обрабатывается антисептиком. Швы не накладываются. Необходим курс подкожного введения антирабической вакцины, который выполняется в специализированных антирабических пунктах, и проведение профилактики столбняка. При наличии поверхностных повреждений (ссадины, царапины) любой локализации кроме области головы, шеи, кистей рук, пальцев ног и гениталий, нанесенных домашними животными, культуральная очищенная концентрированная антирабическая вакцина (КОКАВ) вводится по 1 мл немедленно, а также на 3, 7, 14, 30 и 90 дни. Но если при наблюдении за животным оно остается здоровым в течение 10 суток, то лечение прекращают после 3 инъекции.
При попадании слюны животных на слизистые оболочки, при локализации укусов в области головы, шеи, кистей рук, пальцев ног и гениталий, а также при глубоких и множественных укусах и любых укусах диких животных, кроме введения КОКАВ необходимо немедленное введение антирабического имунноглобулина (АИГ). Гетерологический АИГ назначается в дозе 40 МЕ на кг массы тела, гомологичный – в дозе 20 МЕ на кг массы тела. Большая часть дозы должна быть инфильтрирована в ткани, окружающие рану, остальная часть вводится внутримышечно. Если возможно наблюдение за животным, и оно в течение 10 суток остается здоровым, то введение КОКАВ прекращают после 3 инъекции.
· Во всех случаях контаминированных ран, кроме небольших поверхностных повреждений и случаев, когда имеются косметические и функциональные противопоказания, обязательно проведение первичной хирургической обработки (ПХО) с рассечением раны, ревизией раневого канала, иссечением краев, стенок и дна раны. Цель ПХО в полном удалении нежизнеспособных и контаминированных тканей. Чем позже производится ПХО, тем ниже вероятность предупреждения инфекционных раневых осложнений.
ПХО не проводится при локализации ран на лице, так как приводит к увеличению косметического дефекта, а хорошее кровоснабжение данной области обеспечивает низкий риск нагноений и активное заживление ран. При обширных ранах волосистой части головы выполнение ПХО в полном объеме может привести к невозможности сопоставления краев и закрытия раны. Не подлежат ПХО также колотые непроникающие раны без повреждения крупных сосудов и укушенные раны при подозрении на возможность проникновения вируса бешенства. ПХО может завершаться наложением первичных швов – с ушиванием наглухо либо, при наличии факторов риска нагноения раны, – с оставлением дренажей.
Предпочтительно проточно-промывное дренирование ушитых ран с последующим диализом эффективными антисептиками. Проточно-промывное дренирование осуществляется установкой встречных перфорированных дренажей, по одному из которых вводится лекарственное средство, по другому осуществляется отток. Введение препаратов может быть струйным и капельным, дробным или постоянным. Отток при этом может осуществляться пассивным и активным способом – с помощью вакуумирования.
Данный метод предохраняет раны от вторичного обсеменения, способствует более полному удалению отделяемого, создает условия управляемой абактериальной среды и благоприятные условия для заживления ран. При дренировании необходимо соблюдать несколько общих принципов. Дренаж устанавливают в отлогих местах раневой полости, где максимально скопление жидкости. Выведение дренажной трубки через контрапертуру предпочтительнее, чем через рану, так как дренаж, являясь инородным телом, мешает нормальному заживлению раны и способствует ее нагноению.
При высоком риске развития нагноения раны, например, при наличии резких изменений окружающих тканей, показано наложение первично-отсроченных швов, в том числе провизорных. Как и первичные, эти швы накладываются на рану до развития грануляционной ткани, обычно на 1-5 сутки после ПХО при стихании воспалительного процесса. Заживление таких ран протекает по типу первичного натяжения. Швы не накладываются только после обработки огнестрельных ран и при невозможности сопоставления краев раны без натяжения, в последних случаях показано максимально раннее закрытие раневого дефекта с помощью реконструктивной операции.
· Антибиотикопрофилактика проводится по той же схеме, что и при «грязных» оперативных вмешательствах. Требуется 5-7 дневный курс введения антибиотиков.
· Антисептикопрофилактика предполагает использование эффективных антисептиков на всех этапах операции и при уходе за раной. При обработке ран могут применяться хлоргексидин, гипохлорит натрия, диоксидин, лавасепт, перекись водорода, перманганат калия и другие антисептики. Такие препараты, как фурацилин, риванол, хлорамин, в настоящее время не рекомендуются для использования в хирургических отделениях, так как госпитальная микрофлора устойчива к ним практически повсеместно.
· Ведение раны после проведения ПХО при наложении швов аналогично ведению операционных ран. Выполняется регулярная смена асептических повязок и уход за дренажами. Лечение открытых ран после ПХО производится, как и лечение гнойных ран, в соответствии с фазами течения раневого процесса.
¨ Лечение гнойных ран
· Во всех случаях инфицированных ран, когда нет особых функциональных противопоказаний, производится вторичная хирургическая обработка (ВХО). Она заключается во вскрытии гнойного очага и затеков, эвакуации гноя, иссечении нежизнеспособных тканей и обязательном обеспечении адекватного дренирования раны. Если после проведения ВХО рана не ушивалась, в последующем возможно наложение вторичных швов. В отдельных случаях при радикальном иссечении гнойника при ВХО могут быть наложены первичные швы с обязательным дренированием раны. Предпочтительно проточно-промывное дренирование. При наличии противопоказаний к проведению ВХО ограничиваются мероприятиями по обеспечению адекватной эвакуации экссудата.
· Дальнейшее местное лечение гнойных ран зависит от фазы течения раневого процесса.
В фазе воспаления основные задачи лечения – борьба с инфекцией, адекватное дренирование, ускорение процесса очищения раны, снижение системных проявлений воспалительной реакции. Основой является лечение повязками. Для всех ран, заживающих вторичным натяжением, стандартным методом лечения считается влажная обработка. Сухая обработка с наложением на рану сухих стерильных салфеток используется только для временного покрытия ран и обработки ран, заживающих первичным натяжением.
Смена повязок должна происходить при адекватном обезболивании. Частота смены повязок зависит от состояния раны. Обычно требуется 1-2 смены повязок в день, гидроактивные повязки типа «Гидросорба» могут оставаться на ране несколько дней, необходимость немедленной смены повязки возникает в следующих случаях: пациент жалуется на боль, развилась лихорадка, повязка промокла или загрязнилась, нарушилась ее фиксация. На каждой перевязке рану очищают от гноя и секвестров, иссекают некрозы и промывают антисептиками. Для промывания раны могут использоваться хлоргексидин, гипохлорит натрия, диоксидин, лавасепт, перекись водорода, озонированные растворы. Для ускорения некролиза применяются протеолитические ферменты, УЗ-кавитация, вакуумная обработка раны, обработка пульсирующей струей. Из физиотерапевтических процедур показано УФО раны, электро- и фонофорез с антибактериальными и аналгезирующими веществами.
В фазе регенерации основные задачи лечения – продолжение борьбы с инфекцией, защита грануляционной ткани и стимуляция процессов репарации. Необходимость в дренировании уже отсутствует. Повязки, накладываемые в фазу регенерации, должны защищать рану от травматизации и инфекции, не склеиваться с раной и регулировать влажность среды в ране, препятствуя как высыханию, так и избыточной влажности. Применяют повязки с жирорастворимыми антибактериальными мазями, стимулирующими веществами, современные атравматичные повязки.
· Общее лечение гнойных ран включает антибактериальную терапию, дезинтоксикацию, иммуннотерапию, симптоматическое лечение.
Антибактериальная терапия применяется в 1-2 фазах раневого процесса. Препарат необходимо назначать с учетом чувствительности микрофлоры раны. Показано системное введение антибиотиков, топическое введение в настоящее время не рекомендуется. Первичный эмпирический выбор антибактериальной терапии до получения результатов чувствительности должен быть направлен против типичных возбудителей, которыми являются стафилококки, стрептококки и грамотрицательные аэробные бактерии.
Детоксикация применяется при наличии системных проявлений воспалительного процесса. Используются инфузии солевых растворов, детоксицирующих растворов, форсированный диурез, в тяжелых случаях – экстракорпоральная детоксикация.
Иммунокорригирующая терапия может быть специфическая (вакцинами, сыворотками, анатоксинами) и неспецифическая. Часто применяются столбнячный анатоксин, противостолбнячная и противогангренозная сыворотка, противостолбнячный и антистафилококковый гамма-глобулин. Из средств неспецифической иммунотерапии у больных с гнойными ранами используются только иммуномодуляторы, причем лишь при наличии иммунных нарушений и обязательно в комплексе с антимикробным препаратом, так как они обостряют течение инфекции. Синтетические иммуномодуляторы, такие как диоцефон, полиоксидоний, являются наиболее перспективными. Полиоксидоний имеет свойства не только восстанавливать нарушенный иммунный ответ, но и сорбировать токсины, а также является антиоксидантом и мембраностабилизатором. Обычно назначается по 6 мг 2 раза в неделю, полный курс 5-10 инъекций.
¨ Профилактика инфекционных осложнений операционных ран
Операционные раны наносятся в условиях, минимизирующих риск раневых осложнений. Кроме того, до нанесения раны имеется возможность проведения профилактики раневых осложнений. Профилактика осложнений операционных ран включает:
· Проведение подготовки к операции
Перед плановой операцией проводится тщательное обследование пациента, в ходе которого выявляются имеющиеся факторы риска раневых осложнений. При оценке степени риска учитывается возраст, состояние питания, иммунный статус пациента, сопутствующие заболевания, нарушения гомеостаза, предшествующее медикаментозное лечение, состояние тканей в зоне предполагаемого разреза, вид и длительность предстоящего оперативного вмешательства. Производится коррекция имеющихся нарушений и непосредственная подготовка больного к операции с учетом требований асептики.
При операциях на толстой кишке, а также при обширных оперативных вмешательствах у крайне тяжелых больных для профилактики инфекционных осложнений проводится селективная деконтаминация кишечника. Селективная деконтаминация кишечника снижает риск энтерогенного инфицирования, происходящего в результате транслокации кишечных микроорганизмов. Обычно используется сочетание аминогликозида или фторхинолона с полимиксином и амфотерицином В или флуконазолом.
С каждым днем пребывания в стационаре увеличивается обсемененность пациента возбудителями госпитальных инфекций, поэтому этап стационарной предоперационной подготовки не следует затягивать без необходимости.
· Тщательное соблюдение оперативной техники
При выполнении оперативного вмешательства необходимо аккуратное обращение с тканями, тщательный гемостаз, сохранение кровоснабжения тканей в области раны, облитерация образующегося «мертвого» пространства, сопоставление краев раны и их сшивание без натяжения. Швы не должны быть ишемизирующими, но должны обеспечивать полное смыкание краев раны. По возможности, шовный материал, оставляемый в ране, должен быть рассасывающимся и монофиламентным. Кроме того, большую роль играет длительность операции. С ее увеличением возрастает степень контаминации раны и восприимчивость тканей к возбудителям раневой инфекции за счет подсыхания тканей, нарушения кровоснабжения, реактивного отека.
· Антибиотикопрофилактика
Антибиотикопрофилактика инфекционных раневых осложнений зависит от вида оперативного пособия. При чистых операциях она показана только при наличии факторов, неблагоприятно влияющих на течение раневого процесса, таких как имуннодефицитные состояния, сахарный диабет, прием имуннодепрессантов. При большинстве чистых и условно-чистых операций, а также при загрязненных вмешательствах на верхних отделах ЖКТ для антибиотикоприфилактики могут использоваться цефалоспорины 1-2 поколения, такие как цефазолин или цефуроксим. При загрязненных операциях на толстой кишке, желчевыводящей системе и внутренних половых органах показано применение защищенных аминопенициллинов или цефалоспоринов 1-2 поколения в сочетании с метронидазолом.
При проведении периоперационной профилактики используются средние терапевтические дозы антибиотиков. Первую дозу препарата вводят внутривенно за 30-60 минут до кожного разреза, обычно во время вводной анестезии. При длительности операции более 2-3 часов требуется повторное введение антибиотика для поддержания его терапевтической концентрации в тканях в течение всего оперативного вмешательства. В большинстве случаев продолжительность введения антибиотиков не превышает 24 часов, однако наличие дополнительных факторов риска обуславливает необходимость продления профилактики до 3 суток. При «грязных» вмешательствах показан полноценный курс антибиотикотерапии, который следует начинать еще в предоперационном периоде.
· Антисептикопрофилактика
· Дренирование операционных ран
Дренирование операционных ран проводится по определенным показаниям. Оно необходимо при невозможности облитерации образующегося после операции «мертвого пространства», при большой площади раневой поверхности подкожно-жировой клетчатки, при использовании искусственных материалов для пластики апоневроза и в некоторых других случаях, создающих предпосылки для образования сером. Дренирование также обязательно при радикальном иссечении гнойников с ушиванием послеоперационной раны. Предпочтительно аспирационное или проточно-промывное дренирование, при этом обязателен правильный уход за дренажной системой в послеоперационном периоде.
· Правильное ведение раны в послеоперационном периоде
Назначается холод местно сразу после операции, адекватное обезболивание, производится регулярная смена асептических повязок и уход за дренажами, по показаниям – диализ и вакуумирование раны, физиотерапия и прочие мероприятия.
¨ Контроль лечения ран
Эффективность лечения ран оценивается по динамике общих и местных признаков воспаления. Ориентируются на стихание лихорадки, лейкоцитоза, болей в области раны, нормализацию общего самочувствия больного. Во время перевязок визуально оценивают состояние швов, наличие и распространенность гиперемии и отека в окружности раны, некрозов краев раны, вид раневого отделяемого и грануляций. Для контроля течения раневого процесса при лечении дренированных ран могут применяться инструментальные методы исследования.
Используется эндоскопический метод осмотра раны с одновременной биопсией подкожно-жировой клетчатки для бактериологического исследования. При этом во время перевязки через дренаж послеоперационной раны вводится оптическая трубка эндоскопа с торцевой оптикой диаметром 3-6 мм, оценивается наличие раневого экссудата, участков некроза, фибрина, затем берется биопсия. Степень обсемененности ткани раны определяется с использованием экспресс-методик, например, методом фазово-контрастной микроскопии. После взятия биопсии раневой канал заполняют физиологическим раствором для оценки правильности расположения дренажей и направления потока жидкости при ее струйном введении.
Благоприятными эндоскопическими признаками течения раневого процесса и показанием к прекращению дренирования являются: наличие ярко-розовых грануляций, отсутствие гноя, некрозов, значительного количества фибрина, обсемененность ткани ниже критической. Вялые грануляции, наличие в ране большого количества экссудата и фибрина, а также высокая бактериальная обсемененность требуют продолжения диализа раны растворами антисептиков.
После удаления дренажных систем для оценки состояния раневого канала и окружающих тканей показано ультразвуковое сканирование. Благоприятными ультразвуковыми признаками течения раневого процесса являются:
· сужение раневого канала на следующие сутки после удаления дренажных трубок, визуализация его в виде неоднородной эхонегативной полоски к 3-5 суткам, отсутствие дилятаций и исчезновение канала к 6-7 суткам;
· равномерная эхогенность окружающих тканей, отсутствие в них дополнительных образований.
Неблагоприятными ультразвуковыми признаками течения раневого процесса являются дилятация дренажного канала и повышение эхогенности окружающих тканей с появлением в них дополнительных образований. Данные симптомы указывают на развитие гнойно-воспалительных раневых осложнений еще до появления их клинических признаков.
При лечении гнойной раны необходим ежедневный контроль за течением раневого процесса. При продолжающейся экссудации и вялой грануляции требуется коррекция лечения. Кроме визуальной оценки состояния раны и оценки выраженности общих клинических и лабораторных симптомов применяются различные методы контроля за динамикой микробного пейзажа, уровня обсемененности и регенераторных процессов в тканях: бактериологические, цитологические, современные высокоточные – газожидкостная хроматография, тесты с использованием ферментных систем и прочие.