Ретро вирусная инфекция что это
Ретро вирусная инфекция что это
Ретровирусы содержат две идентичные молекулы геномной РНК и РНК-зависимую ДНК-полимеразу (обратную транскриптазу, ревертазу). Ретровирусы выделены от множества видов животных и проявляют разнообразный спектр патогенного потенциала. Семейство включает вирусы 7 родов: альфа-, бета-, гамма-, дельта-, эпсилонретровирусы, лентивирусы и спумавирусы. Семейство включает вирусы, патогенные для человека и многих видов животных.
Большинство ретровирусов обладают выраженным тропизмом к клеткам лимфОретикулярной и гемопоэтической системы. Ретровирусы у специфических для них видов животных встречаются повсеместно. В борьбе с ретровирусными инфекциями основной мерой является предотвращение передачи вируса.
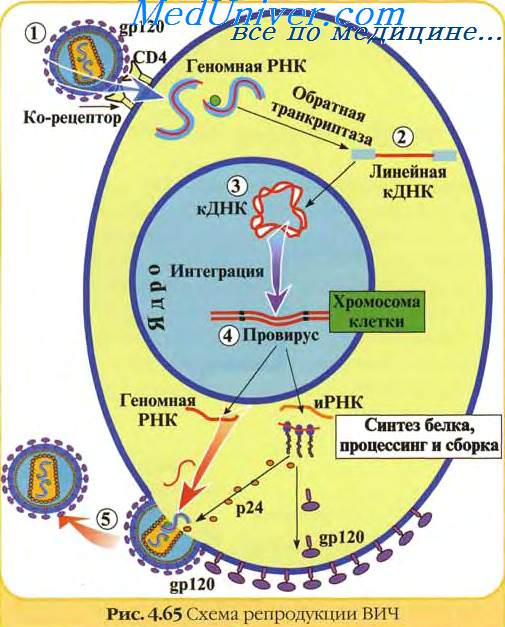
Вирионы ретровирусов представляют собой округлые оболочечные частицы диаметром 80—100 нм, обладающие уникальной трехслойной структурой. Центральная часть вириона представлена нуклеопротеиновым комплексом, который включает около 30 молекул ревертазы и имеет спиральную симметрию. Эта структура окружена икосаэдрическим капсидом диаметром около 60 нм, покрытым оболочкой, происходящей из мембраны клетки, от которой отходят гликопротеиновые пепломеры. Лентивирусы имеют на поверхности примерно 72 шишкоподобных пепломера длиной около 10 нм с яйцевидным концевым уплотнением.
Ретровирусы имеют диплоидный геном, представляющий инвертированный димер из двух молекул линейной позитивной полярности, оцРНК; каждая молекула содержит 7-11 тн и имеет полиА последовательность на З’-конце и КЭП-структуру на 5′-конце. Детальная организация геномов разных ретровирусов широко варьирует.
Геном ретровирусов уникален в следующих отношениях:
1) является единственным диплоидным;
2) вирусная РНК синтезируется и изменяется с помощью механизма, изменяющего клеточную мРНК;
3) это единственный геном, связанный со специфическим переносом функции РНК целиком к первичной репликации;
4) это единственная оц(+)РНК, которая не является мРНК вскоре после инфекции;
5) это единственный геном, кодирующий обратную транскриптазу, которая сама по себе уникальна.
Среди многих своих функций обратная транскриптаза служит в качестве РНК-зависимой ДНК полимеразы, а ДНК-зависимая ДНК полимераза, интеграза и РНКаза, каждая в меру своей определенной функции, представляют различную часть белковой молекулы. Геном недефектных ретровирусов содержит три разных гена, каждый из которых кодирует два и более белка. Gag ген кодирует вирионные коровью белки, pol ген кодирует обратную транскриптазу, a env ген кодирует вирионные пепломерные белки. Геном кодирует также несколько определенных вирионных компонентов.
Геном быстро трансформирующих ретровирусов содержит четвертый ген — вирусный онкоген (v-onc). Присутствие онкогена обычно связано с делецией в другом месте генома, обычно в env гене, так что большинство v-onc содержащих вирусов не способны синтезировать полностью оболочку и поэтому являются дефектными по репликации. Они всегда находят связь с недефектными вирусами, которые реплицируются полностью и функционируют в качестве помощников. Вирус саркомы Рауса является исключением. Его геном содержит вирусный онкоген v-src и также полные gag, pol и env гены, и поэтому является репликативнокомпетентным.
Кроме генов gag, pol и env, общих для всех ретровирусов, лентивирусы кодируют еще несколько других «дополнительных» генов. К ним относятся:
1) tat ген, который кодирует трансактиватор, связанный с клеточными факторами, повышающими эффективность трансляции клеточной РНК полимеразы, главным образом за счет преждевременной остановки транскрипции;
2) rev ген кодирует белок, который связан с удлинением РНК транскриптов и их перемещением из ядра в цитоплазму, обеспечивая полный путь мРНК для трансляции;
3) nef ген, который не требуется для репликации вируса в культуре лимфоцитов, но важен для репликации в макрофагах и для развития болезни, вызванной вирусом иммунодефицита обезьян у обезьян резус; nef белок регулирует экспрессию клеток СД4 и образование ИЛ-2 и может изменять активацию клеток мишеней в организме;
4) vif ген кодирует белок (фактор инфекционности вирусов), который необходим для некоторых стадий вирусного морфогенеза, связанных с инфекционностью.
При продуктивной инфекции вирионы формируются и освобождаются почкованием через плазматическую мембрану. Некоторые ретровирусы вызывают образование опухолей.
Спумавирусы являются необычными ретровирусами во многих отношениях. Они выделены от человека, обезьян, КРС, кошек, морских львов и хомяков. Они представляют проблему, когда контаминируют клеточные культуры, но их связь с заболеваниями неизвестна. Существует мнение, что пенящие вирусы ближе стоят к ДНК гепаднавирусам.
Эндогенный ретровирус свиней (PERV) найден у всех исследованных пород свиней. Известны три субгруппы этого вируса: А, В и С. Все свиньи содержат множественные провирусы (около 50) в своем геноме. PERVлатентно инфицирует многие культуры клеток свиньи и, реже, человека. Патогенность этого вируса не установлена.
Поражение нервной системы ретровирусами: патологическая реакция хозяина или нейровирулентность как результат действия вирусных генов
Кристофер Пауэр
Лаборатория нейровирологии, Неврологическая исследовательская группа, г. Калгари, провинция Альберта, Канада
TRENDS in Neurosciences, Vol. 24, No. 3, March 2001.
Ретровирусы представляют важную группу РНК-вирусов, которые вызывают ряд болезней нервной системы. Более того, потенциальную угрозу представляют вновь выявленные ретровирусные инфекции нервной системы и некоторые ритровирусные векторв или белки, используемые как переносчики генов. Данная статья описывает различные ретровирусы и их этиологическую роль в развитии болезней нервной системы, или, по другому, нейровирулентностъ. Специфические последовательности в пределах ретровирусных генов могут быть ответственны за нейровирулентностъ. Другой механизм заключается в активации иммунных реакций хозяина нейровирулентны-миретровирусами, что запускает нейропатогенетический каскад, медиаторами которого служат провоспалительные и нейротоксичные молекулы, а заканчивается все смертью нейрона. Таким образом, ретровирусные инфекции нервной системы иллюстрируют молекулярное взаимодействие между определенными вирусными возбудителями инфекций и патологическими реакциями хозяина; результатом такого взаимодействия является нейровирулентностъ.
Значение вирусных инфекций нервной системы все время возрастает, что видно по появлению за последние 5 лет нескольких глобальных нейрови-русных эпидемий [1]. Кроме того, повышается интерес в использовании вирусных векторов для генной экспрессии и для лечения заболеваний головного мозга [2]. Инфекцию считают нейровирусной, если она соответствует следующим критериям: нейроинвазивность, или проникновение вируса в нервную систему; нейротропизм (см. список терминов) или инфицирование вирусами клеток головного мозга, причем селективно инфицируются нейроны (это и называется нейротропизмом); и нейровирулентность или заболевание нервной системы, индуцированное вирусами. Хотя многие ретровирусы удовлетворяют этим критериям, но некоторые ретровирусные свойства усложняют их ней-робиологию, среди этих свойств: 1) предрасположенность к геномным мутациям; 2) способность вызывать как врожденный, так и адаптационный иммунный ответ в нервной системе; 3) способность вызывать патологические изменения за пределами нервной системы.
Иммунологические нарушения, вызываемые некоторыми ретровирусами, приводят ко вторичным инфекциям за пределами нервной системы и к злокачественным процессам в нервной системе. Однако, настоящая статья рассматривает только прямую нейровирулентность ретровирусов, с особым вниманием к механизмам нейровирулентности и ней-ротропизма, кроме того, всесторонне описываются ретровирусы типа С (также именуемые онкогенными), в том числе, вирус лейкемии грызунов (MuLV) и вирусы, тропные к человеческим Т-лимфоцитам (HTLV), а также лентивирусы, такие, как вирусы иммунодефицита человека. Нейротропные
штаммы этих вирусов изучались широко. Они способны вызвать серьезные нарушения здоровья у человека.
Таблица 1. Типичные нейротропные ретровирусы: штаммы, нейропатология и клеточный тропизм.
| Группа ретровирусов | Вирус | Патоструктурные измененияв нервной системе а) | Клетки нервной системы инфицированные in vivo |
| Тип С | CasBrE | губчатость, глиоз (СМ) | эндотелий, нейроны, глия |
| NE-8 | губчатость, глиоз (СМ, СтМ, Мзж) | эндотелий, астроциты, нейроны | |
| FrCas е) | губчатость, глиоз (СМ, СтМ, Мзж) | эндотелий, микроглия, нейроны, олигодендроциты | |
| Fr98D | губчатость, глиоз (Мзж, БВ, СВ) | микроглия, нейроны (?) | |
| MoMuLV-tsl | губчатость, глиоз (СМ, СтМ, Тал, СВ,БВ) | эндотелий, астроциты, макрофаги | |
| PCV-211 | губчатость (Пол, СМ, СтМ, Мзж, БВ) | эндотелий | |
| TR1.3 | кровоизлияние (Мзж) | эндотелий | |
| LP-BM5 | глиоз (Пол, Мзж, БВ) | астроциты, микроглия, сосудистое сплетение | |
| WB91-GV | глиоз | олигодендроциты, астроциты | |
| HTLV-I/II | демилиенизация, глиоз, лимфоцитарнаяинфильтрация (СМ) | лимфоциты, астроциты | |
| Лентивирусы | вирус иммуно- дефицита человека | глиоз, микроглиальные узелки, многоядерные гигантские клетки, диффузноепобледнение миелина(СМ, Пол, Мзж, БВ, СВ, ПН) | макрофаги, микроглия, астроциты |
| вирус visna-maedi | глиоз, периваскулярное воспаление, демиелинизация (БВ) | макрофаги, микроглия, астроциты | |
| вирус иммуно- дефицита кошек | периваскулярное воспаление, глиоз, микроглиальные узелки (БВ, СВ, Мзж, СМ, ПН) | макрофаги, микроглия | |
| вирус карпального артрита/энцефалита | глиоз, демиелинизация (БВ) | макрофаги и микроглия | |
| вирус инфекционной анемии лошадей | эпендимит, периваскулрное воспаление (Мзж) | клетки периваскулярных зон и мозговых оболочек | |
| вирус иммуноде- фицита коров | периваскулярное воспаление (БВ) | глиальные клетки | |
| вирус иммуноде- фицита обезьян | периваскулярное воспаление, глиоз, многоядерные гигантские клетки (БВ, Мзж, СВ, СМ) | макрофаги, микроглия, астроциты, эндотелий |
Нейропатологические механизмы развития MuLV-инфекции являются примером взаимодействия разных последовательностей в геноме ретровируса, обычно расположенных в генах env или gag, и параллельно действует патологическая реакция организма-хозяина, определяемая генотипом мыши. Например, у штамма Fr-98 MuLV два отдельных участка гена env регулируют реализацию нейровирулентности в особых мышиных линиях [7], при этом нейровирулентность проявляется в разных нейроповеденческих нарушениях, приводящих к смерти. В отличие от этого штамма, его штамм-предшественник, хотя и имеет похожий клеточный тропизм (микроглия), но авирулентен в отношении нервной системы. У некоторых разновидностей MuLV нейровирулентности способствуют изменения во внутриклеточном цикле и в экспрессии белков MuLV, кодируемых геном env, а также изменения уровня вирусной репликации в головном мозге [7]. Патологические реакции хозяина, инициируемые инфекцией MuLV, остаются плохо изученными, но обнаруживалась корреляция между нейро-вирулентностью и повышенным про-воспалитель-ным образованием цитокинов в гиальных клетках [9]. К другим патологическим реакциям хозяина, индуцируемым инфекцией MuLV, относятся изменение проницаемости гематоэнцефалического барьера и повышение внеклеточной концентрации глутамата, что ведет к смерти нейрона посредством механизма внешней цитотоксичности [10].
Проведено картирование некоторых участков генов хозяина, ответственных за резистентность к неврологическому заболеванию, индуцируемому MuLV. К этим участкам относятся FV-1, FV-4 и Akvr-1, кодирующие эндогенные ретровирусные гены env и gag, которые мешают проявлениям нейровирулентности, так как связываются с предполагаемым рецептором к вирусу, или, может быть, блокируют этап после входа [5]. Кроме того, нейровирулентность, вызванная несколькими разновидностями MuLV, зависит от возраста хозяина, причем новорожденные имеют повышенную подверженность, ввиду слабости иммунной защиты.
Что такое ротавирусная инфекция? Причины возникновения, диагностику и методы лечения разберем в статье доктора Марины Анны Сергеевны, педиатра со стажем в 14 лет.
Определение болезни. Причины заболевания
Ротавирусная инфекция — это острое заболевание, вызываемое ротавирусами, которое преимущественно сопровождается поражением желудочно-кишечного тракта. К характерным симптомам этой инфекции относят многократную рвоту, понос и лихорадку.
Краткое содержание статьи — в видео:
Этиология
Таксономия возбудителя болезни:
Название «Rotavirus» (от лат. «rota» — колесо) было присвоено данному микроорганизму из-за морфологического вида. Его геном состоит из 11-ти двухцепочечных сегментов РНК, окружённых тремя концентрическими капсидами (вирусными оболочками).
Сегменты РНК кодируют шесть структурных (VP1 — VP7) и шесть неструктурных белков (NSP1 — NSP6). Структурные белки в зрелой вирусной частице определяют специфичность хозяина, способность вируса проникать в клетку и его ферментативные функции. Они содержат эпитопы, которые генерируют иммунный ответ. Неструктурные белки принимают участие в репликации генома, т. е. в синтезе вирусных ДНК. Один из них — NSP4 — обладает токсиноподобной активностью.
К настоящему моменту известны десять различных видов ротавируса (от A до J). Они классифицированы по антигенным различиям основного компонента внутреннего капсида VP6. Ротавирус А является наиболее частой причиной развития инфекции у детей. Данный вид ротавируса классифицируют на генотипы по различиям в последовательности сегментов РНК, кодирующих белки наружного капсида VP7 и VP4. У человека выявлено 12 VP7 антигенов (типа G) и 15 VP4 антигенов (типа Р). Сегодня около 90 % всех ротавирусных инфекций человека обусловлено пятью комбинациями G-P типов.
Особенности строения ротавируса делают его высокоустойчивым к воздействию внешних факторов и дезинфицирующих средств. При этом вирус быстро погибает во время кипячения.
Эпидемиология
Источник инфекции — инфицированный человек с явными признаками заболевания или вирусовыделитель (с бессимптомным течением). Больной заразен, начиная с появления первых симптомов и до конца болезни (5-7 дней).
На долю ротавирусного поражения ЖКТ у взрослых приходится от 2 % до 5 % случаев обращения за медицинской помощью. Особенно восприимчивы к заболеванию люди пожилого возраста.
Ротавирусной инфекции свойственен фекально-оральный механизм передачи, т. е. через систему пищеварения. Данный механизм реализуется тремя путями:
Симптомы ротавирусной инфекции
Инкубационный период длится от 12 часов до 5 дней. Клиническая картина заболевания представлена рвотой, лихорадкой и продолжительной водянистой диареей.
В первые дни болезни может отмечаться кратковременный умеренно-выраженный катаральный синдром — заложенность носа, насморк, кашель. Температурная реакция сохраняется 2-4 дня и сопровождается признаками интоксикации — вялостью, слабостью, снижением аппетита. В сыворотке крови у детей с ротавирусным гастроэнтеритом (поражением ЖКТ) отмечается увеличение уровней интерлейкина-6 и фактора некроза опухолей. Это обуславливает лихорадочную реакцию.
Также в первые сутки болезни развивается рвота. Она носит многократный характер и сохраняется до двух суток. Помимо этого отмечается диарея, длительность которой составляет от 2 до 8 суток, частота дефекации — от 3 до 20 раз в день в зависимости от тяжести протекания инфекции.
Дисфункция желудочно-кишечного тракта носит характер гастроэнтерита — воспаления слизистой оболочки желудка и кишечника. Оно сопровождается выделением большого объёма водянистых каловых масс жёлтого оттенка без видимых патологических примесей.
Патогенез ротавирусной инфекции
Размножение ротавируса происходит в зрелых энтероцитах, т. е. вблизи кончиков ворсинок и в энтероэндокринных клетках тонкой кишки. Энтероциты вырабатывают факторы, необходимые для эффективного прикрепления патогена к стенке кишечника. Присоединение ротавируса к клеткам-хозяевам обеспечивается внешним капсидным белком VP4 и партнёрами по связыванию на поверхности клеток-хозяев — ганглиозидами GM1, GD1a и антигенами гистогруппы крови (HBGA).
Взаимодействие ротавируса и HBGA зависит от генотипа ротавируса. После того, как клетка-хозяин поглощает инфекционный агент, в зонах её цитоплазмы происходит синтез и сборка компонентов вируса. Вновь продуцируемые вирусы высвобождаются из клеток путём лизиса (растворения) или везикулярного транспорта (переноса молекул, «упакованных» в пузырьки). Репликация вируса в слизистой оболочке двенадцатиперстной кишки у младенцев вызывает укорочение и атрофию ворсин, потерю микроворсинок и разрастание мононуклеарных клеток.
Ротавирусная диарея имеет два предполагаемых механизма:
Разрушение энтероцитов вирусом приводит к снижению всасывания дисахаридаз, ионов натрия и воды из слизистой оболочки тонкой кишки. Большое количество непереваренных осмотически активных веществ поступает в толстую кишку, которая не способна к их всасыванию, что приводит к осмотической диарее.
Неструктурный белок вируса N SP4, обладающий токсиноподобной активностью, связывается с энтероцитами кишечника и посредством фосфолипазы С повышает уровень цитоплазматического кальция, что в свою очередь активирует кальций-зависимые хлоридные каналы. Их активация вызывает чрезмерную выработку хлоридов, создавая осмотический градиент, который облегчает транспорт воды в просвет кишечника, что приводит к диарее. Совместно с инфекцией, NSP4-опосредованное повышение внутриклеточного уровня кальция может также привести к секреции серотонина энтероэндокринными клетками, который усиливает перистальтику тонкой кишки.
Классификация и стадии развития ротавирусной инфекции
Ротавирусную инфекцию классифицируют по степени тяжести и клинической форме.
Выделяют три степени тяжести:
Тяжесть заболевания определяется количеством эпизодов рвоты, жидкого стула и развитием синдрома дегидратации. При лёгкой степени тяжести признаков обезвоживания не отмечается. При среднетяжёлой наблюдается обезвоживание 1-2 степени. Для тяжёлого течения характерна клиническая картина шока: полуобморочное состояние, жажда, тахикардия, побледнение кожи, падение артериального давления.
По клинической форме выделяют две формы заболевания: типичную и атипичную. Типичная ротавирусная инфекция сопровождается триадой типичных симптомов — рвота, диарея и лихорадка. Течение атипичной формы болезни в свою очередь подразделяют на два типа:
Осложнения ротавирусной инфекции
Осложнения заболевания включают синдром дегидратации, вторичную бактериемию и кандидемию (проникновение бактерий и грибов Сandida в кровь), судороги, асептический менингит, энцефалит, миокардит, бронхопневмонию, гепатит и острую почечную недостаточность.
При оценке состояния пациента необходимо учитывать степень обезвоживания — тип потерянной жидкости (внеклеточная и/или внутриклеточная) и её объём. У детей с ротавирусным гастроэнтеритом потеря жидкости обычно происходит в основном из внеклеточного пространства.
Объём потерянной внеклеточной жидкости объективно измеряется по изменению веса от исходного уровня. Так как часто вес до заболевания достоверно не известен, для оценки степени дегидратации используется ряд клинических признаков (жажда, снижение мочеотделения, вялость, раздражительность), а также время наполнения капилляров и данные объективного осмотра (частота пульса и дыхания, артериальное давление, тургор кожи — скорость расправления кожной складки). По совокупности этих данных дегидратацию делят на степени тяжести:
Следует отметить, что клинические признаки дегидратации являются надёжными показателями при комплексной оценке: по отдельности каждому из них не хватает чувствительности и специфичности.
Для диагностической точности в 2008 году Европейская ассоциация детских гастроэнтерологов, гепатологов и диетологов (ESPGHAN) разработала клиническую шкалу дегидратации. Она учитывает 4 параметра: общий вид, состояние глазных яблок, слизистых оболочек и наличие слезоотделения. Согласно этой шкале:
Все неврологические осложнения ротавирусного гастроэнтерита (судороги, преходящее снижение сознания, энцефалопатия) являются проявлениями внеклеточной дегидратации и обусловлены развитием гипонатриемии — снижения уровня натрия в крови. Тяжесть симптоматики определяется степенью гипонатриемии и темпами её нарастания. Кроме того, у пациентов с ротавирусной диареей и судорожным синдромом и/или энцефалитом была найдена РНК ротавируса в ликворе (спиномозговой жидкости), но диагностическое значение этой находки остаётся неясным.
При сохранении лихорадки или её возобновлении после третьего дня течения ротавирусной инфекции необходимо исключить бактериемию и развитие вторичных бактериальных осложнений. Точный механизм их возникновения неизвестен, но считается, что инфицированные энтероциты во время заболевания становятся более уязвимыми для бактериальной инвазии.
Диагностика ротавирусной инфекции
Антигены ротавируса могут быть обнаружены в кале благодаря иммуноферментному анализу (ИФА), иммунохроматографии и методу обратно-транскриптазной полимеразной цепной реакции (ОТ-ПЦР).
ОТ-ПЦР является высокочувствительным методом, который позволяет генотипировать вирусные изоляты и выявлять вирус в течение более длительного периода по сравнению с ИФА. Количество выделяемой с калом РНК вируса напрямую связан с тяжестью ротавирусной диареи у детей.
Лечение ротавирусной инфекции
В терапии ротавирусного гастроэнтерита используют два подхода:
Этиотропное лечение, направленное на устранение причины заболевания (вируса), не разработано.
Жидкости с избытком глюкозы (газировки и фруктовые соки) усиливают диарею, так как более высокая нагрузка глюкозой увеличивает осмоляльность содержимого в просвете кишечника, что приводит к снижению всасывания воды. Жидкости с высокой концентрацией натрия могут привести к гипернатриемии — повышению уровня натрия в крови.
Пероральная регидратационная терапия делится на две фазы:
Эффективность пероральной регидратационной терапии оценивают по снижению потери жидкости, исчезновению признаков обезвоживания, восстановлению объёма мочи и улучшению состояния ребёнка.
Показаниями к внутривенному введению жидкости являются шок, нарушение сознания, тяжёлый ацидоз (увеличение кислотности организма), отсутствие эффекта от проводимой оральной регидратации и неукротимая рвота. В большинстве случаев для начальной инфузионной терапии рекомендуется изотонический (0,9%) физиологический раствор, который эффективно снижает риск гипонатриемии. Инфузионная терапия, как правило, проводится со скоростью не более 20 мл/кг/ч в течение 2-4 часов. Более быстрое введение растворов может быть сопряжено с развитием электролитных нарушений: брадикардии, отёков и др.
Сорбенты на основе диоктаэдрического смектита также могут быть включены в терапию ротавирусного гастроэнтерита. Для купирования рвоты у маленьких детей эффективным является пероральное (через рот) или внутривенное применение избирательного антагониста серотониновых рецепторов 5НТ 3 — ондансетрона в возрастных дозировках.
Прогноз. Профилактика
При отсутствии симптомов дегидратации прогноз благоприятный, выздоровление наступает через 5-12 дней.
Неспецифическая профилактика заболевания предполагает соблюдение правил личной гигиены (мытьё рук, а при уходе за больным — дополнительную обработку рук спиртосодержащими растворами), своевременную замену нательного и постельного белья, использование для питья кипячённой или бутилированной воды, тщательное мытьё овощей и фруктов. Данная профилактика проводится при угрозе возникновения и распространения болезни, а также в эпидемических очагах при единичных и групповых случаях заболевания.
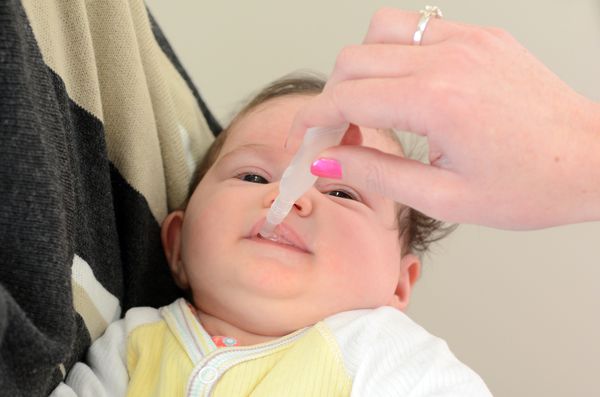
РотаТек рекомендован для активной иммунизации детей с 6-ти недель жизни. Вакцина вводится перорально в серии из трёх доз. Первую дозу необходимо ввести в возрасте 6-12 недель, но не позднее 104 дня жизни. Интервал между дозами составляет 4 недели. Все три дозы должны быть введены до 32 недель жизни младенца.
РотаТек совместима с другими инактивированными одновалентными или комбинированными вакцинами Национального календаря прививок, поэтому их совместное введение не обладает негативным влиянием на иммунный ответ и профили переносимости.