Роландическая эпилепсия у детей что это
Роландическая эпилепсия причины, симптомы, методы лечения и профилактики
Роландическая или доброкачественная эпилепсия – патологическое состояние, возникающее у детей в роландовой области головного мозга, сопровождающееся судорогами лица и иногда тела. Такие приступы врачи называют парциальными, поскольку их природа связана только с одной областью мозга. Распространенность патологии составляет 2 случая на 100 тыс. здоровых детей. Судорожные приступы появляются преимущественно ночью и затрагивают одну сторону лица, языка и глотки. Роландическая эпилепсия имеет благоприятный прогноз и обычно исчезает к 16-18 годам, не вызывая нарушений психофизического развития.
Причины
Причины появления роландической эпилепсии до конца не изучены. Возможно, на развитие патологии оказывают влияние родовые травмы и недостаток кислорода во время беременности. У детей, чьи родители страдают эпилепсией, вероятность развития патологии возрастает. Первые приступы наблюдаются в возрасте 6-8 лет. Они возникают редко, обычно 1-2 раза в год. У взрослых доброкачественная эпилепсия не встречается.
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 17 Декабря 2021 года
Содержание статьи
Симптомы
Перед приступом ребенка беспокоит онемение лица с одной стороны, покалывание в ротовой полости или на языке, ощущение ползания мурашек на щеке. Затем начинаются судорожные подергивания в этих же участках. Родители замечают у ребенка перекос рта, из которого вытекает слюна из-за нарушения контроля мышц. Припадки вызывают изменения речи и повышенную возбудимость, но не приводят к потере сознания. Ребенок хорошо помнит приступ. Он может длится 1-2 минуты.
Врачи не исключают распространение очага возбуждения на другие участки головного мозга и развитие общего тонико-клонического припадка. Для него характерно кратковременное сжимание мышц всего тела, ритмические подергивания всего тела, дезориентацию в пространстве и спутанность сознания.
В некоторых случаях роландическая эпилепсия негативно сказывается на процессе обучения и поведения ребенка. Тогда им требуется дополнительное лечение и внимание.
Диагностика
Для определения диагноза врач проводит опрос родителей пациента, чтобы воссоздать картину болезни. Подтвердить или опровергнуть судорожные состояния можно с помощью электроэнцефалографии. Данный метод считается безболезненным и безвредным. К голове ребенка прикладывают небольшие электроды и закрепляют их с помощью резинового шлема. Электроды усиливают сигналы мозговых клеток в сотни тысяч раз. Процедура никак не влияет на мозг, поэтому ее можно проводить при необходимости.
Дополнительно потребуется сдача общих анализов крови и мочи, биохимия крови. При доброкачественной эпилепсии структурные изменения в полушариях мозга отсутствуют. Наличие патологического очага в области доминантного полушария способно вызывать речевую дисфункцию. При выполнении познавательных тестов отмечаются отклонения, в основном на зрительно-моторную координацию и внимание.
Если врач сомневается в правильности диагноза, он назначает магнитно-резонансную томографию головного мозга. Лечением роландической эпилепсии занимается невролог.
Роландическая эпилепсия у детей
Доброкачественная роландическая эпилепсия – это одна из наиболее распространенных видов эпилепсий. Данная эпилепсия возникает по причине того, что в нервных клетках головного мозга формируется очаг судорожной готовности.
Данная форма эпилепсии может проявиться у детей от 2-х до 14-ти лет. Ее отличительными признаками являются редкие и короткие судорожные припадки, наблюдаемые только на одной стороне лица, глотки и языка. Такие приступы чаще происходят ночью.
Причины роландической эпилепсии
В большинстве случаев причиной роландической эпилепсии является наследственный фактор, который сочетается с незрелостью нервных клеток, а так же других структур головного мозга. В области роландовой борозды формируется зона судорожной готовности. Считается, что роландическая эпилепсия является возрастозависимым заболеванием. Нейроны, по мере их созревания, снижают возбудимость, тем самым происходит постепенное исчезновение очагов судорожной готовности. Следует отметить, что в процессе роста ребенка наблюдается уменьшение эпилептических припадков. До достижения подросткового возраста наблюдается полное выздоровление.
Как проявляется роландическая эпилепсия?
Существует два вида приступов роландической эпилепсии:
Рассмотрим характерные черты роландической эпилепсии у детей:
Диагностика данного вида эпилепсии начинается с жалоб пациента, осмотра. Затем проводятся специфические тесты и электроэнцефалография.
ЭЭГ (электроэнцефалография) является одним из главных методов диагностики данного вида эпилепсии. Обнаруживается наличием высокоамплитудных пиков, а так же волн в центральных височных отделениях головного мозга (так называемый «роландический комплекс»). Эти волны локализуются на той стороне, которая является противоположной судорожному приступу.
Сложность диагностики может возникнуть из-за наступления приступов в ночное время. Например, если проведенное в дневное время ЭЭГ нормальное, но приступы сохраняются, то следует дополнительно провести полисомнографию. Полисомнография – это ЭЭГ, проведенное в ночное время.
Так же, при необходимости, для полной диагностики с другими неврологическими заболеваниями проводится КТ и МРТ (компьютерная томография и магниторезонансная томография).
Лечение роландической эпилепсии
Среди ведущих эпилептологов и детских неврологов ведутся споры на тему целесообразности лечения доброкачественной роландической эпилепсии антиэпилептическими препаратами. Причиной этой дискуссии является вероятность выздоравления пациентов по мере их роста, а так же полное созревание нервной системы без лечения. Но, к сожалению, существует вероятность перехода из роландического вида эпилепсии в более сложные судорожные приступы. При возникновении повторных эпипритсупах назначается специфическое лечение. Помимо этого, детям раннего возраста назначают противосудорожную терапию.
Что делать во время припадка?
Родители не сразу могут заметить приступы эпилепсии у ребенка, так как они возникают ночью. Приступы могут быть единичные и редкие, но как и любая форма эпилепсии, она нуждается в наблюдении врача-эпиептолога и невролога. Важно своевременно диагностировать роландическую эпилепсию. Если необходимо, начать лечение медикаментозно, что, конечно, назначается индивидуально в каждом случае. Также в более пристальном наблюдении нуждается доброкачественная роландическая эпилепсия, которая впервые проявила себя в раннем возрасте, так как возможно приступы будут учащаться из-за того, что нервные клетки еще незрелы.
Во время сложного приступа, сопровождающийся моторными нарушениями (мышечные судороги лица, языка, гортани) необходимо приподнять ребенка и успокоить его. Для того, чтобы язык не западал, следует положить набок голову ребенка, затем в рот вложить какой-нибудь мягкий предмет, например носовой платок. Если приступ продолжается долго, то необходимо вызвать карету скорой помощи или самостоятельно обратиться в медицинское учреждение.
Роландическая эпилепсия у детей что это
Роландическая эпилепсия (детская доброкачественная парциальная эпилепсия с центро-темпоральными спайками, Benign partial Epilepsy of Childhoos with centro-Temporal Spikes, BECTS) представляет собой наиболее часто встречающийся синдром детской идиопатической парциальной эпилепсии и один из самых легко распознаваемых эпилептических синдромов. Этим заболеванием страдают 15-25% больных эпилепсией детей школьного возраста (Heijbel et al., 1975; Dalla Bernardina et al., 2005).
Считается, что синдром является генетически детерминированным, но каков механизм наследования, доминантный или мультифакторный, не выяснено; последнее представляется более вероятным. Результаты недавнего исследования, проведенного на близнецах (Vladlamundi et al., 2006), вызвали сомнения в генетической природе и предположения о возможном значении приобретенных факторов. Проблема усложняется тем фактом, что менее чем у 10% детей с роландическими спайками развиваются припадки, и ЭЭГ-признаки, вероятно, не наследуются. Фокусы характерных роландических острых волн часто выявляются у детей без эпилепсии, и таким образом, диагностическая ценность при изолированном появлении ограничена.
Заболевание почти всегда начинается в возрасте между 2 и 13 годами, редкие случаи отмечаются в возрасте около одного года. Типичными являются «простые» парциальные припадки, то есть протекающие без нарушения сознания. Они в основном характеризуются двигательными проявлениями, хотя часто встречаются парестезии щек и губ, вовлекается преимущественно орофарингеальная мускулатура, что приводит к саливации и/или остановке речи. Отдельные припадки кратковременны (30-60 секунд). От 60 до 80% припадков развивается во время сна или при пробуждении.
Вторичная генерализация развивается у 20% пациентов, в основном среди ночи, тогда как двигательные припадки чаще случаются при засыпании или пробуждении. Может наблюдаться постиктальный транзиторный парез (паралич Тодда). У большинства детей припадки возникают редко, хорошо реагируют на прием противоэпилептических препаратов, на фоне лечения отмечается низкая эпилептогенность фокуса, остающегося клинически «немым» более чем в 90% случаев (Arzimanoglou et al., 2004; Dalla Bernardina et al., 2005).
При неврологическом обследовании пациентов с роландической эпилепсией не выявляется какой-либо патологии; у большинства неврологическое развитие также протекает нормально. Однако наблюдались нарушения речи, от легких до умеренных; в нескольких работах обсуждается состояние когнитивных функций при BECTS (Staden et al., 1988; Deonna 2000; Saint-Martin et al., 2001a; Pinton et al., 2006). В контролируемом исследовании Weglage et al. (1997) часто обнаруживал у детей с центротемпоральными пиками вазомоторные нарушения и проблемы восприятия пространства.
Обязательным изменением на ЭЭГ является наличие специфического типа фокальных эпилептиформных разрядов: фокальных двухфазных медленных пиков, вольтаж от среднего до высокого, с последующими медленными волнами, локализованными в центротемпоральных областях, возможно, с диффузией в смежные области, проявляющихся на фоне нормальной фоновой активности. У более молодых пациентов наблюдается смещение локализации кзади. Эти разряды могут встречаться изолированно или короткими сериями. Часто наблюдается временное исчезновение и миграция пароксизмов из одного полушария в другое. Распределение поля — по типу горизонтального диполя (позитивность в лобной зоне, максимум негативности в роландической области).
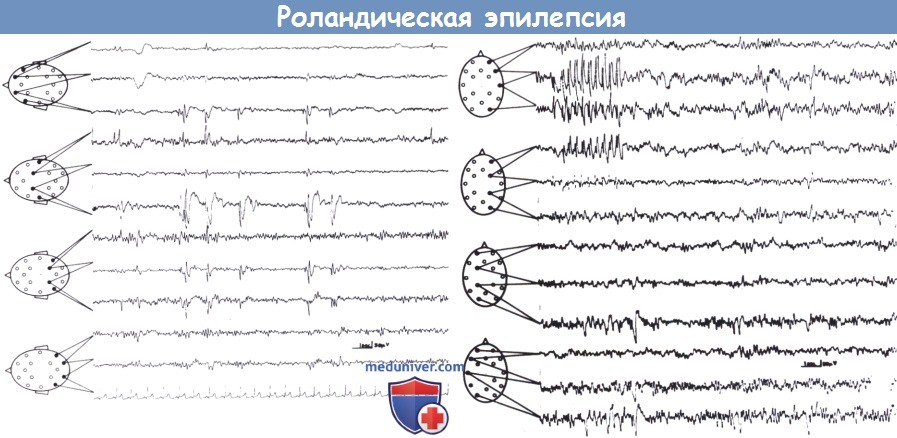
Левосторонний фокус у восьмилетнего мальчика (вверху).
Правосторонний фокус с сериями повторяющихся роландических спаек и волн в правой центротемпоральной области у шестилетнего мальчика (внизу).
В обоих случаях пароксизмальная активность четко соответствует нижним роландическим, среднетемпоральным электродам.
Постоянна активация во время сна. Также возможна локализация в верхней роландической области, но средняя область не вовлекается (Legarda et al., 1994). Однако нередки необычные локализации (Wirrel et al., 1995), и форма пиков более важна для диагностики, чем их точная топография. И все же пароксизмы, совершенно идентичные возникающим при доброкачественной парциальной эпилепсии, при эпилепсиях, вызванных поражениями головного мозга, выявляются редко (Gobbi et al., 1989; Santanelli et al., 1989; Ambrosetto, 1992). Как сообщали некоторые авторы (обзор см. у Dalla Bernardina et al., 2005), наиболее ярким проявлением центротемпоральных пиков является значительное увеличение их частоты при дреме и на протяжении всех стадий сна. Приблизительно у 30% детей они возникают только во время сна.
Исход роландической эпилепсии в отношении припадков исключительно благоприятный. До 25% детей переносят только один припадок, у большинства бывает несколько атак; хотя у некоторых пациентов припадки случаются часто, это не влияет на исход заболевания. Рецидивы в возрасте старше 16 лет исключительно редки (Loiseau et al., 1988). Отдельные генерализованные тонико-клонические припадки наблюдались у нескольких взрослых пациентов после излечения роландической эпилепсии, сообщалось также о нескольких случаях эпилептического статуса. Несмотря на упомянутые выше вероятные проблемы, прогноз для обучения в школе и социального функционирования хороший (Loiseau et al., 1983).
Некоторые исследователи сообщали об атипичных проявлениях доброкачественной парциальной эпилепсии (Aicardi и Chevrie, 1982; Fejerman et al., 2000; Saint-Martin et al., 2001a). У нескольких детей с роландическими фокусами и редкими фокальными ночными припадками, могут развиваться атонические и/или миоклонические припадки, часто возникающие сериями и повторяющиеся много раз в день; такое состояние получило название атипичной доброкачественной парциальной эпилепсии (Aicardi, 2000; Fejerman et al., 2000) или псевдосиндром Леннокса (Hahn et al., 2001) из-за атонических припадков и выраженных нарушений на ЭЭГ.
Атонические атаки особенно выражены и могут возникать десятки раз в день, часто сопровождаются падениями. Серии припадков могут продолжаться 2-3 недели с промежутками в несколько месяцев. У таких детей ЭЭГ, снятая во время сна, очень похожа на ЭЭГ пациентов с продолжительными спайк-волнами во время медленного сна (Aicardi и Chervie, 1982; Aicardi и Levy Gomes, 1992), и на ЭЭГ при пробуждении выявляются множественные билатеральные разряды комплексов спайк-волна. Из-за падений и выраженной пароксизмальной активности во время сна таким пациентам часто ошибочно диагностируется синдром Леннокса-Гасто. Хотя течение этого синдрома может быть благоприятным, со спонтанной ремиссией до достижения возраста 10 лет и после двух или более серий припадков, известны случаи и с более тяжелым исходом (Hahn et al., 2001). Могут сохраняться когнитивные и поведенческие нарушения, но детально они не изучались.
Точное нозологическое определение этого синдрома еще не установлено (Deonna et al., 1986), но очевидна принадлежность к спектру эпилепсий с продолжительными спайк-волнами во время сна (Continuous Spike-Waves during Sleep, CSWS). Парциальный или вторично генерализованный миоклонус может проявляться атоническими эпизодами. Такие эпизоды отмечались у пациентов с доброкачественной парциальной эпилепсией, лечившихся карбамазепином (Caraballo et al., 1989). Однако многие пациенты с синдромом не получали этого препарата (Aicardi и Levy Gomes, 1992).
Сообщалось об эпизодах оперкулярного эпилептического статуса, с вовлечением лица, языка и фарингео-ларингеальных структур (Saint-Martin et al, 1999). Они сопровождались ритмичными разрядами спайк-волна, спайки были синхронными с судорогами лица. Во время таких эпизодов могут наблюдаться псевдобульбарные симптомы, такие как слюнотечение и дизартрия (Roulet et al, 1989; Boulloche et al., 1990; Deonna et al., 1993; Fejerman et al., 2000), иногда встречается истинная афазия (Roulet et al., 1989). Контроль некоторых из этих эпизодов потребовал применения стероидов (Fejerman и Di Blasi, 1987).
Scheffer et al. (1995b) наблюдали тяжелую перманентную речевую диспраксию и нарушения движений рта и щек у несколких членов одной семьи с аутосомно-доминантным механизмом наследования и возможной антиципацией; Guerrini et al. (1999) сообщил о случае пароксизмальной дистонии в форме писчей судороги и атаксии как об аутосомно-рецессивном синдроме, но это состояние отличается от обычного доброкачественного типа. Недавно Roll et al. (2006) идентифицировали Xq22 ген SRPX2, как вызывающий роландические припадки, связанные с оральной и речевой диспраксией и умственной отсталостью.
Редактор: Искандер Милевски. Дата публикации: 4.1.2019
Роландическая эпилепсия у детей
Одна из форм, так называемой, доброкачественной роландической эпилепсии у детей – это роландическая эпилепсия. Термин «доброкачественная», в данном случае, подчеркивает благоприятный исход болезни, т.к. уже к 13 годам симптомы практически полностью исчезают, а после 14 лет не встречаются вовсе. Роландическая эпилепсия характерна только для детей, первые симптомы могут возникнуть в возрасте 2 лет, а в зоне риска чаще мальчики, чем девочки.
Очаг болезни сосредоточен в роландовой области головного мозга, в его височном и центральном отделах. Ряд специалистов считает, что причины возникновения патологии в генетической предрасположенности, однако некоторые врачи склонны полагать, что виной всему нарушения в развитии коры головного мозга. Повышенная возбудимость детского мозга провоцирует зарождение симптомов недуга. Однако, по мере взросления малыша, функционирование головного мозга стабилизируется, и болезнь потихоньку угасает.
Симптоматика роландической эпилепсии у детей заключается в нечастых, обычно кратковременных, парциальных приступах в ночное время либо в период засыпания/пробуждения крохи. Потери сознания не выявлены. По степени выраженности эпиприпадки классифицируют на простые и сложные.
Чаще всего началу приступа предшествует соматосенсорная аура (некое изменение в поведении ребенка, которое может предсказать грядущий припадок). У малыша возникает легкое покалывание либо пощипывание языка и десен, ощущение «ползающих мурашек» в области лица.
Основными симптомами роландической эпилепсии у детей принято считать:
Также ребенок может издавать специфичные горловые звуки, хрипообразное дыхание и проч. Приступ продолжается несколько секунд (максимум до 3 мин). Так как судорожные симптомы в основном случаются ночью, и, бывает, что носят единичный характер, родителям трудно заметить их. В редких случаях болезнь провоцирует осложнения, и относительно умеренные роландические припадки у детей могут перерасти в более сложные формы эпилепсии, поэтому важна ранняя диагностика заболевания и своевременное лечение.
У детишек, страдающих роландической эпилепсией, не наблюдаются явные нарушения поведения или моторики. Возможны небольшие затруднения с обучением, может незначительно снизиться успеваемость в школе. Однако данное заболевание, в большинстве своем, носит временный характер, а значит, никак не повлияет на дальнейшее качество жизни ребенка в будущем!
Цены на консультацию вы можете посмотреть здесь.
Роландическая эпилепсия
К.Ю. Мухин, П.А. Темин, Е.А. Рыкова
Луиджо Роландо (1773-1831 г.), итальянский врач и анатом, дал классическое топографическое описание центральной борозды коры головного мозга. При идиопатической парциальной эпилепсии детского возраста, характеризующейся короткими гемифациальными моторными ночными приступами, часто с предшествующей соматосенсорной аурой и типичными изменениями ЭЭГ (полифазные спайки с локализацией в центральной и срединной височной областях) [14], эпилептогенной зоной являются нижние отделы роландической борозды. Изучение этой разновидности идиопатической парциальной эпилепсии начато более 40 лет назад. Первоначально были описаны специфические изменения ЭЭГ у определенной группы детей. В 1952 г. H.Gastaut [25] впервые обратил внимание на особые эпилептические изменения ЭЭГ у некоторых детей: полифазные спайки со строгой локализацией в перироландической области. Первое клиническое описание симптомов эпилепсии с роландическими спайками (1958 г.) принадлежит Р.Nayras и М.Веаussart [40]. В последующем Е.Gibbs и F.Gibbs [27], С.Lombroso [36], Р.Loisea и соавт. [35] провели клинический анализ симптомов при эпилепсии с роландическими спайками и предложили называть данную форму эпилепсии роландической. Авторы отметили ее благоприятный прогноз и отсутствие симптомов органического поражения центральной нервной системы.
Частота
Большинство авторов отмечают преобладание мальчиков среди больных роландической эпилепсии [3]. Соотношение мальчиков и девочек в среднем составляет 6:4 [11].Среди 100 бальных, наблюдавшихся Р.Lerman [34], было 62 мальчика и 38 девочек.
Клиника
Клиническая симптоматика приступов при роландической эпилепсии, как правило, типична. Наблюдаются простые парциальные (моторные, сенсорные, вегетативные), сложные парциальные (моторные) и вторично генерализованныс приступы. Наиболее типичны простые парциальные моторные и/или сенсорные пароксизмы [2].
У 20% больных судороги могут распространяться с мышц лица на гомолатеральную руку (брахиофациальные приступы) и примерно в 8%случаев вовлекать и ногу (унилатеральные приступы). По мере развития заболевания приступы могут менять сторонность. Вторично генерализованные судорожные приступы отмечаются у 20-25% больных роландической эпилепсии. Они наиболее характерны для младших детей, и возникновение генeрализованных приступов «жестко» приурочено ко сну. Наличие у пациентов длительное время только генерализованных судорожных приступов нехарактерно для РЭ, как и наличие абсансов, психомоторных приступов и приступов с психическими симптомами [5].
Неврологический статус
Неврологический статус у детей, страдающих роландической эпилепсии, изучен достаточно подробно. Роландическая эпилепсия относится к идиопатическим формам эпилепсии, при которых отсутствуют признаки органического поражения головного мозга, что подтверждается большинством публикаций. Более того, по мнению А. Веаumanoir и соавт. [8] наличие таких симптомов противоречит критериям диагноза роландической эпилепсии. Однако в последние годы благодаря внедрению в клиническую практику высокоэффективных нейрорадиологических методов исследования(компьютерная томография, ядерно-магнитный резонанс, позитронная эмиссионная томография) появились единичные сообщения об обнаружении структурных изменений в головном мозге у больных РЭ.
Из 100 больных, наблюдавшихся Р.Lerman и S.Kivity [33], у 4 констатированы симптомы органического поражения центральной нервной системы: детский церебральный паралич (гемипаретическая и тетраплегическая формы), микроцефалия, умеренная задержка умственного развития. Во всех этих случаях диагноз РЭ не вызывал сомнения и был подтвержден как клинически, так и нейрофизиологически. Пневмоэнцефалография не выявила нарушений у данных больных. S.Blom и J.Heijbet [11]в 3 (7,5%) из 40 случаев РЭ обнаружили у больных центральный гемипарез. E.Roulet и соавт. [42] отметили проявления оролингвомоторной диспраксии у больного РЭ. Такие симптомы, как микроцефалия, косоглазие, мозжечковая недостаточность, задержка психического и речевого развития, констатировали у ряда больных РЭ Р.Santanelli и соавт.[43]. Синдром гиперактивности был обнаружен у 16,7%больных РЭ [34].
Генетика
В ряде исследований изучена конкордантность монозиготных близнецов по РЭ. Обнаружена высочайшая конкордантность по наличию на ЭЭГ роландических спайков, но не по развитию самой РЭ. T.Kajitani и соавт. [30] изучили 3 пары монозиготных близнецов в возрасте 5-11 лет, в которых один из сибсов страдал РЭ. Во всех случаях констатирована типичная роландическая эпилептическая активность на ЭЭГ, но ни у одного из здоровых сибсов не было никаких проявлений РЭ.
В последние годы была выдвинута гипотеза о мультифакторном наследовании роландической эпилепсии [29]. Она основывается на том факте, что лишь у небольшой части детей, имеющих на ЭЭГ роландические спайки, в дальнейшем развивается РЭ. Предполагается, что роландические спайки и развитие РЭ детерминированы двумя различными, но сцепленными генами. В 1982 г. O.Eeg-Olofsson и соавт. [22] обнаружили, что у родителей, сибсов и других родственников детей, больных РЭ, низкая встречаемость гаплотипа А1В8 антигенов лейкоцитарной гистосовместимости. Частота его в общей популяции крайне высока [22]- Возможно, что данный гаплотип играет роль протектора или ингибирующего фактора, препятствующего развитию РЭ.
Остается неясной роль экзогенных, средовых факторов в развитии роландической эпилепсии. H.Doose и W.Baier [18] предположили, что генетические факторы при РЭ детерминируют низкий порог судорожной готовности головного мозга. При этом здоровых детей, имеющих на ЭЭГ роландические спайки, они расценили как субклинических носителей с низким судорожным порогом. По мнению авторов, воздействие различных экзогенных факторов в онтогенезе, а также сцепление с другими генами может способствовать у таких пациентов клинической манифестации заболевания и оказывать некоторое влияние на его течение. Т.Каjitani и соавт. [30] описали 3 родных сибсов, у каждого из которых на ЭЭГ имелись типичные роландические спайки. У одного из сибсов РЭ дебютировала в 4 года во время лихорадочного заболевания, у другого отмечался единственный приступ в возрасте 10 лет при просмотре телепередач, третий миновал «критический период» для дебюта и был здоров. Данное наблюдение иллюстрирует полиморфизм клинических проявлений заболевания, что может зависеть от различных экзогенных воздействий.
Факторами, трансформирующими субклиническое носительство в РЭ, могут быть патология беременности и родов, травмы головы, нейроинфекции и пр. [5]. Однако более чем у половины детей, страдающих РЭ, указание на наличие данных факторов в анамнезе отсутствует[15].
Электроэнцефалография
Интересной находкой при РЭ является обнаружение на ЭЭГ наряду с типичными роландическими комплексами и других эпилептических паттернов. От 10 до 20% детей с РЭ имеют на ЭЭГ пик-волновые комплексы в других зонах коры, главным образом в затылочной области [41]. Морфология «затылочных комплексов «близка к роландическим и к наблюдаемым при доброкачественной фокальной эпилепсии с затылочными пароксизмами [10]. По мнению J.Aicardi [5],частота «затылочных комплексов» при Рэо братно пропорциональна возрасту ребенка и является нередкой у больных до 3 лет жизни. От 7% [34]до 20% [5] пациентов с РЭ демонстрируют на ЭЭГ типичную генерализованную пик-волновую активность с частотой 3-4 Гц, нередко возникающую при гипервентиляции. У отдельных больных возможно появление медленных пик-волновых комплексов. Большинство авторов придерживаются однозначного мнения об отсутствии корреляции между частотой и выраженностью пик- волновыхкомплексов на ЭЭГ и особенностями течения заболевания.
Исследование ЭЭГ во время приступа представляется довольно сложным ввиду низкой частоты приступов при РЭ. B.Dalla-Bernardina и соавт. [15]описали во время ночного приступа появление на ЭЭГ низкоамплитудной быстрой активности в центрально-височной области, переходящей в роландические комплексы с распространением на всю гемисферу и с последующим охватом всего полушария.
Нейрорадиологическое исследование
Лечение
За последние годы в лечении РЭ апробирован целый ряд противоэпилептических препаратов. Большинство авторов рекомендуют применять препараты, преимущественно воздействующие на парциальные формы эпилепсии: карбамазепин (финлепсин, тегретол) и дифенин (фенитоин). При лечении РЭ необходимо избегать политерапии, а также на значения противосудорожных препаратов в высоких дозах. Доброкачественное течение РЭ, отсутствие интеллектуально-мнестических нарушений у пациентов не дают оснований рекомендовать «агрессивную» антиконвульсантную политерапию для лечения данной формы эпилепсии ввиду возможности развития тяжелых побочных эффектов.
По мнению P.Lerman [34], а также В. Dalla-Bermardina и соавт.[15], одним из препаратов выбора влечении РЭ является фенитоин в низких и средних дозах. При возникновении приступов исключительно в ночное время или в период пробуждения рекомендован однократный прием фенитоина на ночь. Во всех наблюдавшихся авторами случаях применение средних терапевтических доз фенитоина приводило к полной клинической ремиссии приступов. Согласно данным P.Lerman и S.Kivity [33], эффективность фенитоина в лечении РЭ превышает таковую карбамазепина и фенобарбитала.
Карбамазепин также высокоэффективен в лечении РЭ [41] и отличается от дифенина минимальной выраженностью побочных эффектов терапии.
Сультиам (осполот) эффективен и хорошо переносится больными РЭ [19]. Применение барбитуратов (фенобарбитал, бензонал) лимитировано частым и тяжелым побочным влиянием на интеллектуально-мнестическис функции и поведение детей [5] и не может быть рекомендовано для лечения РЭ.
В последние годы появились публикации, свидетельствующие об эффективности препаратов вальпроевой кислоты (депакин, конувулекс) при РЭ[6,15,29]. Важной особенностью их является позитивное влияние на интеллектуально-мнестические функции пациентов и хорошая переносимость [12]. Однако, катамнестические исследования эффективности применения вальпроатов при РЭ отсутствуют.
Большинство авторов считают, что продолжительность применения антиконвульсантов при РЭ не должна превышать 2 лет с момента последнего приступа [35]. В среднем продолжительность медикаментозного лечения при РЭ составляет 3,2 года [33]. Однако в случае раннего дебюта приступов (2-3 года) лечение должно быть продолжено до 10-летнего возраста, независимо от длительности ремиссии [4]. Лечение рекомендуется назначать только после повторного приступа. Сохранение на ЭЭГ типичной эпилептической активности не может являться причиной продолжения антиконвульсантной терапии, если у больного имеется длительная ремиссия.
Прогноз
Учитывая генерализованный характер приступов, появление их спустя длительное время после наступления ремиссии, отсутствие роландических спайков на ЭЭГ, P.Lerman [34] предположил, что данные случаи не имеют отношения к РЭ и представляют собой возникновение эпилепсии de novo. Противоречит данной концепции тот факт, что частота рецидивов при РЭ (2-4%) значительно превышает популяционную частоту эпилепсии (0,8%). Возможно, в возникновении приступов во взрослом возрасте при РЭ играет роль взаимодействие экзогенных факторов с генетически детерминированным снижением порога судорожной готовности. Одним из «разрешающих» факторов может явиться нарушение гормонального баланса в организме.
Дальнейшие исследования покажут соотношение генетических и экзогенных факторов в детерминации РЭ и возможность существования «симптоматических» форм РЭ, обусловленных структурными изменениями, локализованными в роландической области. Необходимо также проведение молекулярно-генетических исследований с целью поиска генов, ответственных за развитие РЭ. Это позволит определить взаимосвязь РЭ с другими формами идиопатической эпилепсии, такими как доброкачественная затылочная эпилепсия Гасто, детская абсанс-эпилепсия и др.
ЛИТЕРАТУРА
I. Бадалян Л.О., Темин П.А., Мухин К.Ю. Фебрильныесудороги. Методические рекомендации. М. 1987; 24.
5. Aicardi J. Epilepsy in children 1986; 4.
6. Ambrosetto G., Tenuper P., Baruzzi A. J Neural Neurosurg Psychiat 1985; 48: 90.
17. Deonna Th., Zieglev A.-L., Despland P.-A. Guyvan Меllе. Epilepsia 1986; 27: 241- 247.
19. Doose H. Epileptic syndromes in enfancy, childhood and adolescence. Paris 1992; 103- 114.
29. Heijbel J. Pediatric Epilepsy. Helsinky 1989.
38. Mambelli M., Moscano F., Maroni P. et al. Bulll. Liga Int. Epilepsy 1985; 51/52: 79- 80.

