С чего начинается эндоцитоз
С чего начинается эндоцитоз
• Для захвата материала из окружающей среды клетка использует несколько различных механизмов
• В последующих превращениях захваченного материала важную роль играют ферменты деградации и низкое значение pH в эндосомах и лизосомах
Эндоцитоз — процесс, при котором эукариотическая клетка захватывает материал из окружающей среды при образовании везикул на плазматической мембране. Во многом являясь противоположностью экзоцитоза, эндоцитоз обладает несколькими функциями:
• поглощение питательных веществ;
• регуляция экспрессии белков на клеточной поверхности, например рецепторов гормонов и переносчиков глюкозы, что дает возможность клетке контролировать процесс захвата лигандов;
• захват и деградация внеклеточного дебриса;
• восстановление мембраны, встроенной в плазматическую мембрану при секреции.
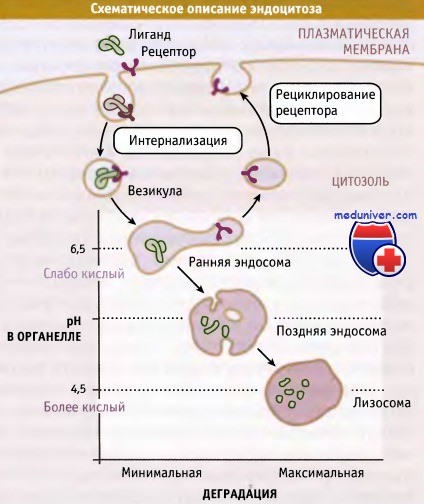
При эндоцитозе макромолекулы или рециклируют в плазматическую мембрану, или разрушаются.
Наряду с этим, процесс эндоцитоза используется для проникновения в клетку патогенными организмами, такими как бактерии, простейшие и вирусы.
При эндоцитозе образующиеся на плазматической мембране везикулы сливаются с органеллами. Эти органеллы обладают двумя важными особенностями: в люмене у них поддерживается кислая среда, и находятся протеолитические ферменты, оптимальная активность которых проявляется при кислых значениях pH.
Органеллы характеризуются различной степенью кислотности среды и различным содержанием ферментов деградации. Они подразделяются на ранние и поздние эндосомы и лизосомы, которые обладают широким спектром протеолитической активности соответственно от минимального в эндосомах до максимального в лизосомах.
В лизосомах находятся ферменты деградации, активные по отношению практически ко всем биополимерам (белкам, липидам, углеводам, РНК, ДНК), попадающим в них путем эндоцитоза. Хотя в течение долгого времени лизосомы рассматривались как терминальные органеллы на пути эндоцитоза, существуют данные о том, что они иногда могут сливаться с плазматической мембраной.
Протонный насос, функционирующий за счет энергии АТФ, называется вакуолярной АТФазой (v-АТФаза) и переносит ионы Н+ из цитозоля в люмен определенных органелл. При этом pH внутри органелл, по сравнению с цитозолем, уменьшается. Значение pH цитозоля составляет 7,4. Внутри ранних эндосом поддерживается слегка кислое значение pH (6,5-6,8), а в поздних эндосомах и в лизосомах значение pH достигает 4,5.
Величина pH в различных эндосомальных компартментах регулируется разными факторами, такими как содержание и активность v-АТФазы, а также ионной проводимостью и свойствами других транспортных АТФаз, присутствующих в мембранах различных эндосом. Важно отметить, что pH в каждом компартменте зависит от выполняемой им функции.
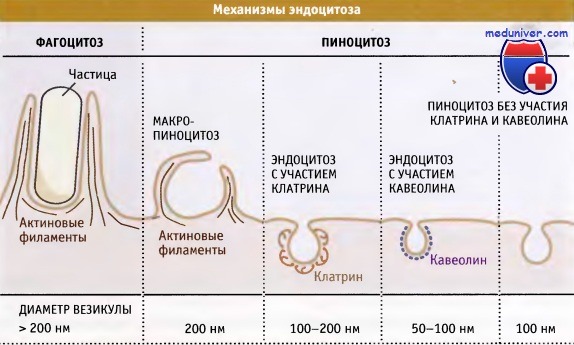
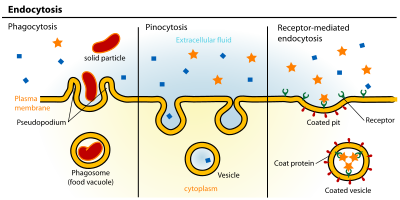
Исторически сложилось так, что эндоцитоз стали подразделять на фагоцитоз («поедание клеткой») и пиноцитоз («впитывание клеткой»), что отражает объем попадающего в клетку материала. Специализированный фагоцит, например макрофаг, может заключать материал в везикулу, диаметром до 10 мкм. Сходство с процессом поглощения пищи подчеркивается также сильно кислой внутренней средой фагосом, оптимальной для активности ферментов, расщепляющих поглощенные белки, липиды и углеводы.
Почти все клетки обладают способностью к фагоцитозу, однако этот процесс наиболее характерен для специализированных клеток иммунной системы, таких как макрофаги и дендритные клетки, поглощающих патогенные микроорганизмы и помогающих формировать ся защитной реакции у организма хозяина. Макрофаги также участвуют в очистке организма от стареющих или апоптотических клеток путем фагоцитоза, происходящего даже в отсутствие инфекции. Поскольку настоящие фагоциты обладают специфическими рецепторами, запускающими фагоцитоз, они более эффективны в захвате частиц по сравнению с другими клетками. Например, макрофаги и некоторые другие фагоцитирующие клетки экспрессируют рецепторы для молекул антител.
Пиноцитоз представляет собой общий термин, включающий несколько механизмов захвата. Обычно при этом образуется небольшая эндоцитозная везикула, достигающая 0,1-0,3 мкм в диаметре. Наиболее полно изученной разновидностью пиноцитоза является эндоцитоз, опосредуемый рецепторами. В ранних исследованиях по захвату липопротеинов низкой плотности (ЛНП) соответствующими рецепторами было получено много концептуальных сведений, способствующих нашему пониманию механизмов эндоцитоза. Большое количество рецепторов, расположенных на поверхности клеток, связывает лиганды, к числу которых относятся питательные вещества, ростовые факторы, гормоны, антитела или антигены.
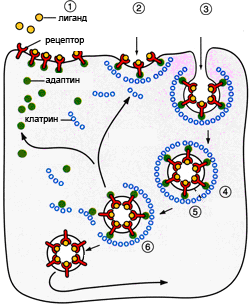
Комплексы «рецептор-лиганд» поглощаются, накапливаясь в специфических областях плазматической мембраны, которые называются «окаймленные ямки». Окаймленные ямки отпочковываются, образуя везикулы, которые сливаются с ранними эндосомами. В кислой среде внутри эндосом связь некоторых лигандов с рецепторами разрывается, причем рецепторы направляются назад, на поверхность клетки, а лиганды — в поздние эндосомы и потом в лизосомы. Некоторые комплексы рецептора и лиганда в ранних эндосомах не диссоциируют, а вместо этого, так же как свободные лиганды, направляются в лизосомы.
Существует несколько вариантов основного пути эндоцитоза. Некоторые клетки содержат лизосомы, в которых происходит лишь частичная деградация поглощенного материала, что существенно для выработки иммунного ответа на захваченные патогены. Хорошим примером являются дендритные клетки, представляющие собой клетки лейкоцитарного происхождения, присутствующие в крови и во всех тканях организма.
Они инициируют почти все иммунные реакции, что обусловлено их уникальной способностью стимулировать В- и Т-лимфоциты, узнающие и уничтожающие патогены. Дендритные клетки захватывают циркулирующие антигены или патогенные микроорганизмы и доставляют их в специальный компартмент лизосом. Эти лизосомы не обладают способностью к полному перевариванию белков, что благоприятствует образованию коротких пептидов (10-15 остатков аминокислот), связывающихся с белками главного комплекса гистосовместимости класса II (МНС). Еще одна особенность этих лизосом позволяет комплексам пептидов и МНС класса II выходить из них за счет образования длинных трубочек, по которым содержимое транспортируется к плазматической мембране. Затем комплексы пептида и МНС класса II выходят на поверхность мембраны, где они стимулируют эффекторные клетки.

поглощающего эритроцит.
Еще один вариант эндоцитоза предполагает, что поглощенный клеткой материал полностью минует лизосомный путь. Этот процесс носит название трансцитоз, он характерен для специализированных эпителиальных клеток, выстилающих полости тела, например внутреннюю поверхность кишечника.
Функция эпителиальных клеток состоит в регуляции транспорта материалов между организмом и окружающей средой. Эти клетки тесно примыкают друг к другу и образуют непрерывный слой. Они поляризованы, причем «апикальная» поверхность обращена в сторону люмена кишки, а «базальная» — в противоположную сторону, к крови. Обычно трансцитоз начинается с образования покрытой клатрином везикулы на апикальной или базолатеральной мембране. Эта везикула сливается с ранней эндосомой, что приводит к образованию трансцитозной везикулы, принадлежащей к типу рециклирующих везикул. Трансцитозная везикула переносится на противоположную поверхность клетки и сливается с мембраной.
При всасывании в кишечнике питательных веществ некоторые транспортные везикулы, которые образуются при эндоцитозе на апикальной поверхности, продвигаются прямо на базальную сторону и таким образом доставляют интернализированные компоненты без риска их разрушения в лизосомах. Еще одним примером трансцитоза является перенос факторов гуморального иммунитета от матери к новорожденному. Иммуноглобулины, присутствующие в материнском молоке, в кишечнике ребенка захватываются апикальными рецепторами, которые транспортируют их на другую сторону эпителия и доставляют в плазму крови.
Наряду с переносом через окаймленные ямки, на плазматической мембране образуются другие типы эндоцитозных везикул. Кавеолы представляют собой небольшие инвагинации в поверхности мембран, покрытые кавеолином. По-видимому, в кавеолах накапливаются некоторые рецепторы и мембранные липиды, которые не переносятся через окаймленные ямки. Эти рецепторы и липиды попадают в клетку, когда кавеола отпочковывается, образуя везикулу. Плазматическая мембрана также образует более крупные гетерогенные структуры, которые называются макропиносомы.
Обычно они образуются в ответ на действие факторов роста и представляют собой большие вакуоли, похожие по размеру на фагосомы. В них могут содержаться крупные капли внеклеточной жидкости. Материал, попавший в клетку с помощью кавеол и макропиносом, достигает тех же эндосом и лизосом, так же как и материал, поглощенный через окаймленные ямки. В некоторых случаях содержимое кавеол может храниться в специальной эндосоме, которая называется кавеосома. Наконец, некоторые метаболиты попадают в клетку вместе с мелкими пиноцитозными везикулами, которые образуются в отсутствие известных типов оболочек (окаймления).
Интересно, что некоторые вирусы животных используют кислые значения pH, характерные для эндоцитоза, для проникновения в цитоплазму клетки, где они проходят цикл репликации. Так, вирусы везикулярного стоматита и леса Семлики проникают в клетку через кислое окружение люмена эндосом; при этом активируются гликопротеины «шипов» на поверхности вирусной частицы и запускается процесс слияния мембран вируса и эндосомы. При этом происходит попадание в цитоплазму клетки вирусного генома и начинается распространение инфекции.
В клетках почкующихся дрожжей S. cerevisiae происходит пиноцитоз, но не фагоцитоз. Это не вызывает удивления, поскольку дрожжевая клетка обладает толстой клеточной стенкой. У этих клеток плохо различимы органеллы, принимающие участие в эндоцитозе, поскольку их очень мало. Однако вакуоли, которые представляют собой аналоги лизосом, хорошо видны в электронном микроскопе. До недавних пор генетические исследования эндоцитоза на дрожжах отставали от исследований экзоцитоза, и лишь в последнее время они стали особенно важны для понимания роли убиквитинирования белков в процессе их деградации.
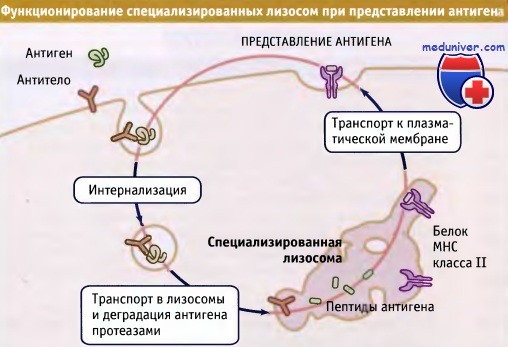
образуя пептиды, которые связываются с молекулами МНС класса II.
Комплексы пептид-МНС класса II транспортируются в плазматическую мембрану для представления антигена эффекторным клеткам. 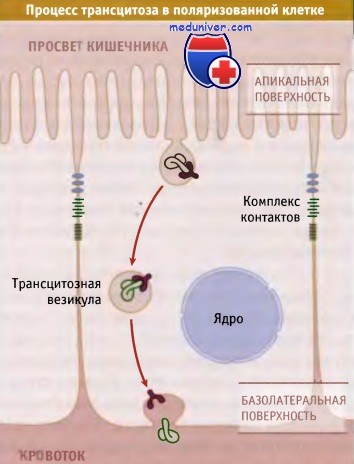
что материал, транспортируемый по механизму эндоцитоза из одного мембранного домена,
проходит через клетку и путем экзоцитоза выходит через другой мембранный домен.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза
Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза
Олигомеризация молекул клатрина, участвующих в процессе активного эндоцитоза
Автор
Редакторы
В статье рассмотрены различные виды рецептор-опосредованного эндоцитоза и стратегии по доставке лекарств внутрь клетки.
Внедрение нового лекарственного соединения в клиническую практику определяется двумя основными факторами — эффективностью его действия на ту или иную клеточную мишень и сохранением высокого уровня активности при использовании in vivo. Зачастую при разработке нового препарата вопросам его доставки к мишени уделяют неоправданно мало внимания. В то же время понятно, что никого не заинтересует лекарство, которое будет обладать изумительной активностью in vitro, однако при этом, например, не будет проникать через гематоэнцефалический барьер или же обладать низкой специфичностью. Тем не менее, современные знания о механизмах внутриклеточного транспорта и молекулярной организации клеточной поверхности позволяют разрабатывать новые эффективные технологии направленной доставки лекарств. Использование таких подходов позволяет увеличить специфичность действия препаратов и тем самым снизить их токсичность, а также уменьшить действующие концентрации. Особое значение эффективная внутриклеточная доставка приобретает при терапии онкологических заболеваний. Низкая избирательность действия, а также первичная и приобретенная в процессе лечения резистентность опухолевых клеток к химиопрепаратам — являются одними из главных причин, существенно ограничивающих эффективность противоопухолевой химиотерапии. Повышение селективности химиопрепаратов может быть достигнуто посредством их направленного транспорта к клеткам-мишеням с помощью различных белковых векторов, которые позволяют доставлять химиопрепараты, а также другие активные соединения внутрь клетки в результате рецептор-опосредованного эндоцитоза. Далее мы поговорим о различных современных стратегиях доставки лекарств, основанных на этом механизме.
Рецептор-опосредованный эндоцитоз
Рисунок 1. Этапы эндоцитоза, опосредованного рецепторами. 1. Связывание лиганда с рецептором. 2. Формирование окаймленной ямки. 3. Образование клатриновой везикулы. 4–6. Внутриклеточная утилизация.
Способность клетки поглощать различные макромолекулы и частицы в результате инвагинации плазматической мембраны называется эндоцитозом. Существует два основных пути такого транспорта. Жидкофазный (конститутивный) эндоцитоз — это неизбирательный процесс, при котором концентрация веществ, поглощаемых в составе везикул, соответствует концентрации веществ во внеклеточной жидкости. Такие везикулы образуются чрезвычайно активно. Расходуемая на везикулы мембрана быстро восстанавливается. Опосредуемый рецепторами эндоцитоз (рис. 1) представляет собой избирательный концентрирующий механизм, позволяющий клеткам захватывать большие количества специфических лигандов без поглощения соответственно большего объема внеклеточной жидкости. При этом поглощаются макромолекулы, для которых на плазмалемме существует ограниченное число связывающих участков. Эти рецепторы, обладают высоким сродством к определенным веществам. Они выборочно поглощают их из среды клетки и концентрируют. При этом жидкости и растворенные в ней посторонние, несвязывающиеся с рецепторами молекулы, почти не поглощаются. Так обеспечивается эффективное поступление специфических молекул в клетку. Везикулы, образующиеся при таком эндоцитозе, формируются в месте инвагинаций плазмалеммы, покрытых с цитоплазматической стороны волокнистым материалом — мембранным белком клатрином. Предварительно на мембране образуются окаймленные клатрином ямки, которые могут занимать до 2% поверхности некоторых клеток. С помощью окаймленных ямок, в которых располагаются соответствующие рецепторы, интернализуются ряд веществ, например, липопротеины низкой плотности, факторы роста, гормоны и пр. [1].
Стратегии внутриклеточной доставки лекарств
Использование белковых векторов, специфичных к клеточным рецепторам
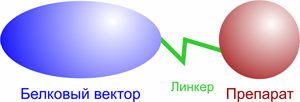
Рисунок 2. Структура конъюгата
В разработке противораковых препаратов широкое распространение получил подход с использованием гибридных конструкций типа белковый вектор + химиопрепарат, ковалентно связанных друг с другом (далее конъюгат, рис. 2.). Избирательность действия конъюгатов достигается либо за счет наличия на поверхности опухолевых клеток специфических рецепторов, «узнаваемых» векторным белком или антителом, либо за счет значительно более высокого уровня рецепторов векторного белка на поверхности опухолевых клеток по сравнению с нормальными. В ряде работ опубликованы данные об успешном применении цитотоксических конъюгатов, созданных на основе цитотоксических антибиотиков и векторных молекул, осуществляющих направленную доставку антибиотика в опухолевые клетки или эндотелиальные клетки сосудов опухоли [2]. В качестве векторов активно используют онкофетальные белки, трансферрин, моноклональные антитела к специфическим опухолевым антигенам, гормоноподобные пептиды (см. далее).
Конъюгация препарата с белковым вектором может быть осуществлена несколькими способами: с помощью химической сшивки (в простейшем случае — дисульфидная или тиоэфирная связь) полиэтиленгликолевого (PEG) или полипептидного линкера, авидин–биотин технологии. В любом случае, способ конъюгации должен удовлетворять двум основным критериям: высокий выход реакции и возможность внутриклеточного расщепления. Структура линкерного фрагмента может не подразумевать его клеточное расщепления, при этом «независимость» препарата от вектора обеспечивается значительной длиной линкера. В этом случае обычно используют PEG, масса которого может достигать 2–3 кДа [3].
В качестве противоопухолевых препаратов обычно используют цитотоксические антибиотики (например, интеркаляты в ДНК, такие как doxorubicin), индукторы апоптоза (напр. camptothecin) и др.
Таким образом, специфичность действия конъюгата будет определяться, прежде всего, структурой и типом белкового вектора, которые мы будем обсуждать далее.
Трансферрин–трансфериновый рецептор
Поскольку ионы Fe 3+ нерастворимы, а Fe 2+ обладают токсичностью, транспорта железа (Fe 3+ ) в организме осуществляется в комплексе с глобулиновым белком — трансферрином (Trf). Транспорт железа в клетку происходит в результате эндоцитоза, опосредованного взаимодействием Trf со своим рецептором (TfrR) [4]. Трансферрин широко используется как белковый вектор для направленной доставки противораковых препаратов белков и генов опухолевой клетки, которая характеризуется повышенным уровнем экспрессии TfrR. Tfr-специфичная внутриклеточная доставка достигается конъюгацией данного вектор с рядом противоопухолевых препаратов (doxorubicin, daunorubicin) и белковых токсинов (СRM107, ricin) [5]. Использование таких конструкций позволяет существенно снизить токсичность химиотерапии, а также противостоять механизмам приобретенной резистентности раковых клеток.
Гормоны и их рецепторы
В качестве векторов не менее эффективно могут быть использованы пептидные гормоны, имеющие на поверхности клеток специфические к ним рецепторы. В частности установлено, что для рецепторов десятичленного пептида гонадолиберина (LHRH) наблюдается повышенная экспрессия в опухолевых клетках при развитии рака молочной железы, яичников и простаты [6], [7]. Поэтому LHRH может быть использован для направленной доставки лекарств к таким злокачественным образованиям. Так, для конъюгата, состоящего из LHRH, PEG и camptothecin’а была показана хорошая противоопухолевая активность на мышах. Данная конструкция была не токсична, и при этом не наблюдалось существенного физиологического эффекта на репродуктивные функции испытуемых животных, связанного с повышением концентрации LHRH [6].
Онкофетальные белки
Наиболее изученным представителем данного класса является α-фетопротеин (α-FP). Это гликопрпотеин (69 кДа), близкий по структуре к сывороточному альбумину человека. α-FP появляется в развивающемся эмбрионе млекопитающих и полностью исчезает из крови сразу после рождения. Однако он может появляться в крови взрослых особей при развитии рака печени и репродуктивных органов. α-FP в крови способен связывать различные компоненты сыворотки, включая жирные кислоты, стероиды и пр., а также обладает сродством к поверхности раковых клеток [8], [9]. Это позволяет также использовать его в качестве вектора. Конъюгирование α-FP с различными цитотоксическими антибиотиками (doxorubicin, carminomycin) позволяют увеличить их противораковую эффективность. В экспериментах in vivo для таких конъюгатов было показано ингибирование опухолевого роста и заметное увеличение продолжительности жизни мышей, подвергаемых терапии [10], [11].
Моноклональные антитела
Наиболее широко в качестве векторов используются моноклональные антитела (mAB) к различным рецепторам на поверхности раковых клеток (TrfR, рецептор фактора роста эпителия (EGFR), CD-рецепторы). Выработка таких mAB лежит в основе действия онковакцин. Кроме того, иногда используют радиомеченные mAB, которые связываются с клеткой и вызывают ее гибель за счет присутствия в их структуре радионуклидов. Также mAB часто конъюгируют с цитотоксическими антибиотиками и другими лекарственными препаратами с помощью различных линкеров (авидин–биотин, PEG и пр.) [12]. Использование конъюгатов на основе mAB к рецепторам часто бывает эффективней, чем использование в качестве векторов естественных лигандов. Так, например, Tfr обладает ограниченной способностью проникать через гематоэнцефалический барьер, что не позволяет использовать его в терапии онкологических заболеваний мозга. В то же время антитела к TfrR беспрепятственно проникают к различным тканям мозга [13].
«Троянские» пептиды
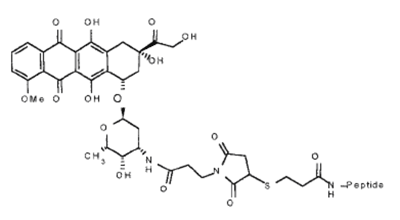
В качестве альтернативы классическим белковым векторам, которые обеспечивают интернализацию конъюгата с помощью рецептор-опосредованного эндоцитоза, можно использовать «троянские» пептиды (или CPP — cell penetrating peptides). Данные пептиды способны доставлять в клетки различные ковалентно пришитые гидрофильные молекулы (ДНК, белки, лекарства) без нарушения целостности плазматической мембраны, что делает их перспективными объектами современной молекулярной медицины. Пенетратин (pAntp), 16-членный фрагмент гомеодоменного белка Антеннопедии из D. melanogaster [14] является типичным и наиболее изученным представителем CPP. Однако, несмотря на колоссальное число работ, посвященных pAntp, механизм его переноса через клеточную мембрану остается до конца не установленным. Известно, что для pAntp возможно как прямое (за счет дестабилизации бислоя) проникновение в клетку, так и посредством эндоцитоза [15]. Возможно, энергозависимый путь проникновения CPP в клетку связан с рафт-опосредованным эндоцитозом [16]. Использование таких пептидов в качестве вектора является перспективным, поскольку гибридные конструкции зачастую обладают гораздо меньшими размерами, по сравнению с описанными выше конъюгатами, и просты в получении. В частности для pAntp с ковалентно пришитым doxrubicin’ом (рис. 3) было показано эффективное подавление опухолевого роста в мозге мышей [17]. При этом pAntp обеспечивал доставку doxrubicin’а через гематоэнцефалический барьер.
Рисунок 3. Структура гибридной конструкции doxorubicin—D-pAnt. Пептид: RQIKIWFQNRRMKWKK (все D-аминокислоты).
Эндоцитоз это клеточный процесс в котором вещества вносятся в камеру. Материал, который нужно усвоить, окружен областью клеточная мембрана, который затем отрастает внутри клетки, образуя везикул содержащий проглоченный материал. Эндоцитоз включает: пиноцитоз (клеточное питье) и фагоцитоз (поедание клеток). Это вид активного транспорта.
Содержание
История
Срок был предложен Де Дуве в 1963 г. [1] Фагоцитоз был обнаружен Эли Мечников в 1882 г. [2]
Пути эндоцитоза
Пути эндоцитоза можно разделить на четыре категории: рецептор-опосредованного эндоцитоза (также известный как клатрин-опосредованный эндоцитоз), кавеолы, пиноцитоз, и фагоцитоз. [3]
Более поздние эксперименты показали, что эти морфологические описания эндоцитозных событий могут быть неадекватными, и более подходящий метод классификации может быть основан на клатриновой зависимости конкретных путей с множественными подтипами клатрин-зависимого и клатрин-независимого эндоцитоза. Механистическое понимание нефагоцитарного, независимого от клатрина эндоцитоза отсутствует, но недавнее исследование показало, как Граф1 регулирует широко распространенные клатрин-независимый эндоцитарный путь известный как путь CLIC / GEEC. [10]
Основные компоненты эндоцитарного пути
Эндоцитарный путь клеток млекопитающих состоит из отдельных мембранных компартментов, которые интернализируют молекулы из плазматической мембраны и рециркулируют их обратно на поверхность (как в ранних эндосомах и рециркулирующих эндосомах) или сортируют их на деградацию (как в поздних эндосомах и лизосомах). Основные компоненты пути эндоцитоза: [3]
Недавно было обнаружено, что эизосома служит порталом эндоцитоза у дрожжей. [17]
Клатрин-опосредованный эндоцитоз
Основным путем эндоцитоза в большинстве клеток и наиболее понятным является путь, опосредованный молекулой клатрин. [18] [19] Этот большой белок способствует образованию ямок, покрытых оболочкой на внутренней поверхности плазматическая мембрана ячейки. Затем эта ямка прорастает в клетку, образуя везикулу, покрытую оболочкой, в цитоплазме клетки. При этом он вводит в ячейку не только небольшую площадь поверхности ячейки, но и небольшой объем жидкости извне ячейки. [20] [21] [22]
Оболочки функционируют, чтобы деформировать донорскую мембрану с образованием везикул, а также они действуют в отборе груза везикул. Комплексы оболочки, которые до сих пор были хорошо охарактеризованы, включают белок оболочки-I (COP-I), COP-II и клатрин. [23] [24] Клатриновые оболочки участвуют в двух важнейших транспортных стадиях: (i) рецепторно-опосредованный эндоцитоз и эндоцитоз в жидкой фазе от плазматической мембраны к ранней эндосоме и (ii) транспорт от TGN к эндосомам. При эндоцитозе клатриновая оболочка собирается на цитоплазматической стороне плазматической мембраны, образуя ямки, которые инвагинируют, чтобы отщипнуть (расслоение) и стать свободными CCV. В культивируемых клетках сборка CCV занимает
1 мин, и каждую минуту может образовываться от нескольких сотен до тысячи и более. [25] Основным каркасным компонентом клатриновой оболочки является белок массой 190 кДа, называемый тяжелой цепью клатрина (CHC), который связан с белком массой 25 кДа, называемым легкой цепью клатрина (CLC), образуя трехногие тримеры, называемые трискелионами.
Везикулы избирательно концентрируются и исключают определенные белки во время образования и не являются репрезентативными для мембраны в целом. Адаптеры AP2 представляют собой мультисубъединичные комплексы, которые выполняют эту функцию на плазматической мембране. Наиболее изученными рецепторами, сконцентрированными в покрытых оболочкой везикулах клеток млекопитающих, являются рецепторы Рецептор ЛПНП (который удаляет ЛПНП из циркулирующей крови), рецептор трансферрина (который переносит ионы трехвалентного железа, связанные трансферрин в клетку) и рецепторы некоторых гормонов (например, EGF).
В любой момент около 25% плазматической мембраны фибробласта состоит из покрытых ямками. Поскольку покрытая ямка живет около минуты, прежде чем она прорастет в клетку, фибробласт захватывает ее поверхность этим путем примерно раз в 16 минут. Покрытые оболочкой везикулы, образованные из плазматической мембраны, имеют диаметр около 36 нм и время жизни, измеряемое в несколько секунд. Как только шерсть сброшена, оставшаяся везикула сливается с эндосомы и проходит по эндоцитарному пути. Фактический процесс почкования, в результате которого ямка превращается в пузырьки, осуществляется клатрином с помощью набора цитоплазматических белков, который включает динамин и адаптеры, такие как адаптироваться.
Покрытые ямки и пузырьки впервые были замечены на тонких срезах ткани в электронном микроскопе Мэттом Лайонсом и Паркером Джорджем. Важность их для очистки крови от ЛПНП была обнаружена Ричардом Г. Андерсоном, Майкл С. Браун и Джозеф Л. Гольдштейн в 1977 г. [26] Покрытые везикулы сначала были очищены Барбара Пирс, который открыл молекулу клатриновой оболочки в 1976 году. [27]