с чем принимать лизин
Лизин (100 табл.)
Парадигма (NOW Foods)
США
100 табл.
🗹 Оригинальный товар с гарантией качества.
Состав
Действие
Как известно, стресс является одной из основных причин рецидивов генитального герпеса. Повышение уровня стероидных гормонов во время стресса приводит к резкому расходованию и истощению запасов л-лизина в организме. На основе л-лизина строятся защитные антитела и другие важные клетки иммунной системы. Снижение уровня защитных клеток приводит к очередному, сильному рецидиву. Сам по себе рецидив является для нервной системы и организма еще большим стрессом: Вы не можете нормально жить половой жизнью, Ваши половые органы зудят и саднят, Вы ссоритесь с близкими, не справляетесь с профессиональными обязанностями и т.п.
Научные эксперименты показали, что при длительном применении L-Лизин обладает, кроме противогерпетического, еще и мягким антидепрессантоподобным эффектом, также на фоне приема L-Лизина у некоторых людей прошли мучающие их мигренозные головные боли.
Л-лизин не вызывает сонливости, снижения концентрации внимания и работоспособности, психической или физической зависимости. После приема Л-лизина Вы можете спокойно водить автомобиль. Напротив же, недостаток L-лизина в рационе питания может быть причиной повышенной утомляемости, тошноты, головокружения, вялости, пониженного аппетита, нервозности, появление сосудов на белочной оболочки глаза (симптом «красных глаз»), менструальной дисфункции.
При длительном потреблении Л-лизин не накапливается и не оказывает токсического воздействия на организм человека: используется, как источник энергии. Излишки выводятся почками с мочой.
Таким образом, получается, что L-Лизин имеет два механизма действия:
Показания
Способ употребления
Побочные действия и противопоказания
Индивидуальная непереносимость компонентов. Во время беременности лучше воздержаться от применения L-Лизина, поскольку имеются сведения о том, что препарат тормозит рост плода.
Детям лучше воздержаться от приема Лизина, поскольку в опытах над животными показано, что его повышенные концентрации могут тормозить рост.
Стоит ли пить добавки с железом?
Почему возникает дефицит
Самая частая причина — кровопотери, например из-за травмы или болезни кишечника, а также из-за слишком сильных менструальных кровотечений.
«Дефицит железа лежит в основе более половины анемий, — говорит к. м. н. кардиолог и диетолог, GMS Clinic Наталья Поленова. — Основные причины дефицита железа: несбалансированная диета, нарушение всасывания, циклические кровопотери у женщин репродуктивного возраста, донорство, беременность, лактация, быстрый рост в пубертатном периоде».
Вторая причина — плохое всасывание железа. Это может происходить при приеме лекарств, хронических болезнях кишечника, воспалениях или генетических нарушениях.
Гематолог ФГБУ «НМИЦ Гематологии» Минздрава России уточняет, что железодефицитные состояния возникают при многих заболеваниях с нарушениями всасывания, начиная от серьезных онкологических и заканчивая гельминтозами и наличием бактерий Helicobacter pylori, которые поглощают железо.
Как узнать о наличии анемии
Обычно на начальных стадиях железодефицитные состояния внешне не проявляются. Но могут появиться незначительные симптомы, которые обычно игнорируются и приводят к дальнейшему развитию болезни.
«При недостатке железа нарушается процесс образования белка, который переносит кислород к клеткам — гемоглобина. Когда его мало снижается работоспособность, повышается усталость, возникают одышка, головокружения и обмороки при незначительных нагрузках», — говорит гематолог.
Узнать о недостатке железа в организме можно только по анализу крови. Сдавать его имеет смысл если появились все симптомы без видимой на то причины.
В списке анализов обязательно должны быть тест на уровень гемоглобина, гематокрит, средний объем эритроцитов (MCV) и среднее содержание гемоглобина в эритроцитах (MCH).
Наталья Поленова отмечает, что назначения одного общего анализа крови с оценкой уровня гемоглобина часто бывает недостаточно, особенно для женщин или людей с хронической сердечной недостаточностью.
Только врач может, изучив анализы, выявить причину дефицита и назначить лечение.
Кому и как нужно принимать железо
Без одобрения врача — никому. Витамины и БАДы с дополнительным железом могут быть опасны. Например у людей с нарушением обмена железа, его излишки в рационе приводят к развитию цирроза печени, сахарного диабета и кардиомиопатий.
«Перегрузка железом из-за необдуманного приема препаратов ведет к очень опасным последствиям. В практике несколько раз встречались пациенты с перегрузкой железа. Их печень больше похожа на металлический таз», — рассказывает гематолог.
При наличии железодефицитной анемии простой диеты или БАДов будет мало. Такие серьезные состояния лечат с помощью инъекций железа и лекарственных препаратов.
Если в анализах врач увидит небольшой дефицит железа, то лучше всего его регулировать с помощью добавления продуктов содержащих железо. Оно в пище бывает гемовое — легкоусвояемое и негемовое — трудноусвояемое. Гемовое железо содержится в мясе, птице, рыбе и морепродуктах. Оно легко усваивается и не зависит от других пищевых факторов.
«Главные источники пищевого железа — красное мясо и субпродукты, особенно, печень, — говорит Наталья Поленова. — Железа в них много, и оно хорошо усваивается. Далее по списку следуют рыба и морепродукты, в особенности сардины, тунец, креветки, мидии и моллюски. Кроме самой рыбы, довольно много железа содержится в ее икре».
Негемовое железо содержится в основном в растительных продуктах. Но для того чтобы организм усвоил его нужна помощь органических кислот, прежде всего аскорбиновой.
Поленова уточняет, что из растительных продуктов больше всего железа в свекле, спарже, цветной и белокочанной капусте и шпинате. Но для успешного усвоения понадобятся, например, цитрусовые соки. При составлении рациона нужно учитывать, что железо усваивается из пищи на 10–15%.
С чем принимать лизин
Лизин – алифатическая кислота, которая играет важную роль в выработке различных ферментов и гормонов, а также при формировании костей и мышц. Лизин относится к незаменимым аминокислотам, то есть он не вырабатывается организмом, а поступает извне вместе с пищей.
Лизин приобрел особую популярность в 80-х годах ХХ века благодаря своей способности бороться с вирусом простого герпеса. Помимо этого ряд исследований демонстрируют полезные свойства лизина для улучшения спортивных результатов, поддержки иммунной системы и секреции инсулина. Также лизин понижает уровень триглицеридов в сыворотке крови, а в сочетании с пролином и витамином С предупреждает образование липопротеинов, вызывающих закупорку артерий. Большие дозы лизина улучшают усвоение кальция.
При недостатке лизина у человека могут развиваться различные патологические состояния: анемия, отеки, лихорадка, депрессия, утомляемость, волдыри, потеря волос, потеря концентрации внимания, потеря мышечной массы, язва желудка, проблемы с печенью, иммунодефицитные состояния.
Для профилактики всех этих состояний следует включить в свой рацион продукты, богатые лизином, либо использовать биологически активные добавки, содержащие лизин.
Суточная потребность в лизине составляет для младенцев (до 4 мес) – 103 мг/кг, для детей до 2-х лет – 64 мг/кг, для подростков – 60 мг/кг, для взрослых – 12 мг/кг.
Суточную норму лизина необходимо увеличить при безжировой диете, людям, придерживающимся веганского или вегетарианского типа питания, при недостаточно разнообразном питании, в пожилом возрасте, спортсменам.
Лизин можно получить из различных пищевых продуктов, особенно много его в продуктах, богатых белком. Так, в 100 г яичного белка содержится 5,5 г лизина, в 100 г сыра пармезан или говядины – 3,6 г лизина, в 100 г петрушки, грудки курицы или индейки, спирулины – 3 г лизина.
Употребление достаточного количества лизина с пищей не только помогает поддерживать здоровье, но и снизить риск различных проблем.
Как упоминалось выше, было обнаружено, что лизин эффективен в лечении герпеса, вызванного вирусом простого герпеса.
Поскольку лизин помогает организму более эффективно усваивать кальций, увеличивается прочность костей и снижается риск возникновения остеопороза.
Также лизин (в сочетании с аргинином) может помочь увеличить выработку гормонов роста. Лизин может помочь улучшить здоровье сердца, поддерживая производство карнитина, ответственного за снижение уровня липопротеинов низкой плотности. Лизин (совместно с витамином С и пролином) снижает риск развития сердечных заболеваний и инсульта. Достаточный уровень лизина в организме может помочь улучшить психическое здоровье, препятствуя пагубному воздействию стресса. Есть сведения об эффективности лизина для снижения риска осложнений диабета 2 типа, согласно которым лизин может влиять на структуру и функцию гликозилированного лизоцима.
При использовании биологически активных добавок с лизином могут возникать такие побочные эффекты, как диарея, тошнота, боль в животе, дисфункция почек.
Лизин хорошо усваивается организмом в присутствии витаминов А, В1, С, а также железа и биофлавоноидов. Также стоит отметить, что максимально эффективен лизин в случае присутствия организма достаточного количества аргинина. Поэтому, для получения максимальной пользы, ваше питание должно содержать в себе все эти питательные вещества.
Большинство продуктов, богатых лизином, также содержат большое количество белка. В среднем на каждые 0,5 кг массы нужно употреблять 0,5 г белка. Это количество удовлетворит все потребности организма и не вызовет дефицит лизина и других аминокислот.
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
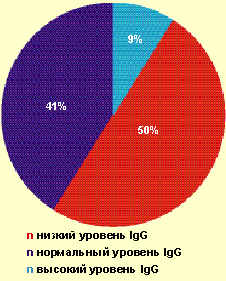 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
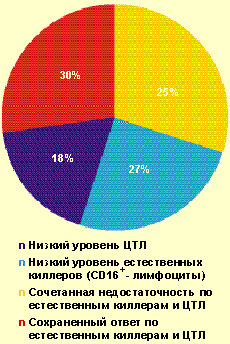 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва
Алгоритм метаболизма

Решение организационных вопросов питания у лиц старших возрастов, разработка и назначение индивидуализированных рационов рационального, профилактического и лечебного питания в существенной степени зависит от правильной оценки врачом нутриционного статуса пожилого человека, особенностей состояния обменных процессов. Именно поэтому профессионально грамотный клиницист, участвующий в решении проблем лечебно-профилактического питания у лиц пожилого и старческого возраста, должен быть достаточно хорошо ориентирован в области основ клинической биохимии и физиологии питания стареющего организма.
Белковый обмен
Белки — сложные азотсодержащие биополимеры, мономерами которых служат аминокислоты (органические соединения, содержащие карбоксильные и аминные группы). Их биологическая роль многообразна. Белки выполняют в организме пластические, каталитические, гормональные, транспортные и другие функции, а также обеспечивают специфичность. Значение белкового компонента питания заключается прежде всего в том, что он служит источником аминокислот.
Аминокислоты делятся на эссенциальные и неэссенциальные в зависимости от того, возможно ли их образование в организме из предшественников. К незаменимым аминокислотам относятся гистидин, лейцин, изолейцин, лизин, метионин, фенилаланин, триптофан и валин, а также цистеин и тирозин, синтезируемые соответственно из метионина и фенилаланина. Девять заменимых аминокислот (аланин, аргинин, аспарагиновая и глутамовая кислоты, глутамин, глицин, пролин и серин) могут отсутствовать в рационе, так как способны образовываться из других веществ. В организме также существуют аминокислоты, которые продуцируются путем модификации боковых цепей вышеперечисленных (например, компонент коллагена — гидроксипролин — и сократительных белков мышц — 3-метилгистидин).
Большинство аминокислот имеют изомеры (D- и L-формы), из которых только L-формы входят в состав белков человеческого организма. D-формы могут участвовать в метаболизме, превращаясь в L-формы, однако утилизируются гораздо менее эффективно.
Взаимоотношение аминокислот
По химическому строению аминокислоты делятся на двухосновные, двухкислотные и нейтральные с алифатическими и ароматическими боковыми цепями, что имеет большое значение для их транспорта, поскольку каждый класс аминокислот обладает специфическими переносчиками. Аминокислоты с аналогичным строением обычно вступают в сложные, часто конкурентные взаимоотношения.
Так, ароматические аминокислоты (фенилаланин, тирозин и триптофан) близкородственны между собой. Хотя фенилаланин является незаменимой, а тирозин — синтезируемой из него заменимой аминокислотой, наличие тирозина в рационе как будто бы «сберегает» фенилаланин. Если фенилаланина недостаточно или его метаболизм нарушен (например, при дефиците витамина С) — тирозин становится незаменимой аминокислотой. Подобные взаимоотношения характерны и для серосодержащих аминокислот: незаменимой — метионина — и образующегося из него цистеина.
Триптофан в ходе превращений, для которых необходим витамин В 6 (пиридоксин), включается в структуру НАД и НАДФ, то есть дублирует роль ниацина. Приблизительно половина обычной потребности в ниацине удовлетворяется за счет триптофана: 1 мг ниацина пищи эквивалентен 60 мг триптофана. Поэтому состояние пеллагры может развиваться не только при недостатке витамина РР в рационе, но и при нехватке триптофана или нарушении его обмена, в том числе вследствие дефицита пиридоксина.
Аминокислоты также делятся на глюкогенные и кетогенные, в зависимости от того, могут ли они при определенных условиях становиться предшественниками глюкозы или кетоновых тел (см. табл. 1).
Таблица 1. Классификация аминокислот
| Виды | Эссенциальные аминокислоты | Неэссенциальные аминокислоты |
| Алифатические | Валин (Г), лейцин (К), изолейцин (Г, К) | Глицин (Г), аланин (Г) |
| Двухосновные | Лизин (К), гистидин (Г, К)* | Аргинин (Г)* |
| Ароматические | Фенилаланин (Г, К), триптофан (Г, К) | Тирозин (Г, К)** |
| Оксиаминокислоты | Треонин (Г, К) | Серин (Г) |
| Серосодержащие | Метионин (Г, К) | Цистеин (Г)** |
| Дикарбоновые и их амиды | Глутамовая кислота (Г), глутамин (Г), аспарагиновая кислота (Г), аспарагин (Г) | |
| Иминокислоты | Пролин (Г) |
Обозначения: Г — глюкогенные, К — кетогенные аминокислоты; * — гистидин незаменим у детей до года; ** — условно-незаменимые аминокислоты (могут синтезироваться из фенилаланина и метионина).
Необходимые азотсодержащие соединения
Поступление азотсодержащих веществ с пищей происходит в основном за счет белка и в менее значимых количествах — свободных аминокислот и других соединений. В животной пище основное количество азота содержится в виде белка. В продуктах растительного происхождения большая часть азота представлена небелковыми соединениями, также в них содержится множество аминокислот, которые не встречаются в организме человека и зачастую не могут метаболизироваться им.
Синтез пуриновых оснований
Человек не нуждается в поступлении с пищей нуклеиновых кислот. Пуриновые и пиримидиновые основания синтезируются в печени из аминокислот, а избыток этих оснований, поступивших с пищей, выводится в виде мочевой кислоты.
Прием белка
Обычный (но не оптимальный) ежедневный прием белка у среднестатистического человека составляет приблизительно 100 г. К ним присоединяется примерно 70 г белка, секретируемого в полость желудочно-кишечного тракта. Из этого количества абсорбируется около 160 г. Самим организмом в сутки синтезируется в среднем 240–250 г белка. Такая разница между поступлением и эндогенным преобразованием свидетельствует об активности процессов обратного восстановления исходного сложного химического соединения из «осколков», образовавшихся при его метаболизме (ресинтеза белков из аминокислот, а аминокислот из аммиака и «углеродных скелетов» аминокислот).
Азотное равновесие
Для здорового человека характерно состояние азотного равновесия, когда потери белка (с мочой, калом, эпидермисом и т. п.) соответствуют его количеству, поступившему с пищей. При преобладании катаболических процессов возникает отрицательный азотный баланс, который характерен для низкого потребления азотсодержащих веществ (низкобелковых рационов, голодания, нарушения абсорбции белка) и многих патологических процессов, вызывающих интенсификацию распада (опухолей, ожоговой болезни и т. п.). При доминировании синтетических процессов количество вводимого азота преобладает над его выведением, и возникает положительный азотный баланс, характерный для детей, беременных женщин и реконвалесцентов после тяжелых заболеваний.
После прохождения энтерального барьера белки поступают в кровь в виде свободных аминокислот. Следует отметить, что клетки слизистой оболочки желудочно-кишечного тракта могут метаболизировать некоторые аминокислоты (в том числе глутамовую кислоту и аспарагиновую кислоту в аланин). Способность энтероцитов видоизменять эти аминокислоты, возможно, позволяет избежать токсического эффекта при их избыточном введении.
Аминокислоты, как поступившие в кровь при переваривании белка, так и синтезированные в клетках, в крови образуют постоянно обновляющийся свободный пул аминокислот, который составляет около 100 г.
Путь белка
75 % аминокислот, находящихся в системной циркуляции, представлены аминокислотами с ветвящимися цепями (лейцином, изолейцином и валином). Из мышечной ткани в кровоток выделяются аланин, который является основным предшественником синтеза глюкозы, и глутамин. Многие свободные аминокислоты подвергаются трансформации в печени. Часть свободного пула инкорпорируется в белки организма и при их катаболизме вновь поступает в кровоток. Другие непосредственно подвергаются катаболическим реакциям. Некоторые свободные аминокислоты используются для синтеза новых азотсодержащих соединений (пурина, креатинина, адреналина) и в дальнейшем деградируют, не возвращаясь в свободный пул, в специфичные продукты распада.
Роль печени
Постоянство содержания различных аминокислот в крови обеспечивает печень. Она утилизирует примерно ⅓ всех аминокислот, поступающих в организм, что позволяет предотвратить скачки в их концентрации в зависимости от питания.
Первостепенная роль печени в азотном и других видах обмена обеспечивается ее анатомическим расположением — продукты переваривания попадают по воротной вене непосредственно в этот орган. Кроме того, печень непосредственно связана с экскреторной системой — билиарным трактом, что позволяет выводить некоторые соединения в составе желчи. Гепатоциты — единственные клетки, обладающие полным набором ферментов, участвующих в аминокислотном обмене. Здесь выполняются все основные процессы азотного метаболизма: распад аминокислот для выработки энергии и обеспечения глюконеогенеза, образование заменимых аминокислот и нуклеиновых кислот, обезвреживание аммиака и других конечных продуктов. Печень является основным местом деградации большинства незаменимых аминокислот (за исключением аминокислот с ветвящимися цепями).
Инсулиновый ответ
Синтез азотсодержащих соединений (белка и нуклеиновых кислот) в печени весьма чувствителен к поступлению их предшественников из пищи. После каждого приема пищи наступает период повышенного внутрипеченочного синтеза белков, в том числе альбумина. Аналогичное усиление синтетических процессов происходит и в мышцах. Эти реакции связаны прежде всего с действием инсулина, который секретируется в ответ на введение аминокислот и/или глюкозы.
Некоторые аминокислоты (аргинин и аминокислоты с ветвящимися цепями) усиливают продукцию инсулина в большей степени, чем остальные. Другие (аспарагин, глицин, серин, цистеин) стимулируют секрецию глюкагона, который усиливает утилизацию аминокислот печенью и воздействует на ферменты глюконеогенеза и аминокислотного катаболизма. Благодаря этим механизмам происходит снижение уровня аминокислот в крови после поступления их с пищей. Действие инсулина наиболее выражено для аминокислот, содержащихся в кровотоке в свободном виде (аминокислот с ветвящимися цепями), и малозначимо для тех, которые транспортируются в связанном виде (триптофана). Обратное инсулину влияние на белковый метаболизм оказывают глюкокортикостероиды.
Аминокислоты на «экспорт»
Печень обладает повышенной скоростью синтеза и распада белков по сравнению с другими тканями организма (кроме поджелудочной железы). Это позволяет ей синтезировать «на экспорт», а также быстро обеспечивать лабильный резерв аминокислот в период недостаточного питания за счет распада собственных белков.
Особенность внутрипеченочного белкового синтеза заключается в том, что он усиливается под действием гормонов, которые в других тканях производят катаболический эффект. Так, при голодании белки мышц, для обеспечения организма энергией, подвергаются распаду, а в печени одновременно усиливается синтез белков, являющихся ферментами глюконеогенеза и мочевинообразования.
Избыток белка и голодание
Прием пищи, содержащей избыток белка, приводит к интенсификации синтеза в печени и в мышцах, образованию избыточных количеств альбумина и деградации излишка аминокислот до предшественников глюкозы и липидов. Глюкоза и триглицериды утилизируются как горючее или депонируются, а альбумин становится временным хранилищем аминокислот и средством их транспортировки в периферические ткани.
При голодании уровень альбумина прогрессивно снижается, а при последующей нормализации поступления белка медленно восстанавливается. Поэтому хотя альбумин и является показателем белковой недостаточности, он низкочувствителен и не реагирует оперативно на изменения в питании.
7 из 10 эссенциальных аминокислот деградируют в печени — либо образуя мочевину, либо впоследствии используясь в глюконеогенезе. Мочевина преимущественно выделяется с мочой, но часть ее поступает в просвет кишечника, где подвергается уреазному воздействию микрофлоры. Аминокислоты с ветвящимися цепями катаболизируются в основном в почках, мышцах и головном мозге.
Роль мышц
Мышцы синтезируют ежедневно 75 г белка. У среднего человека они содержат 40 % от всего белка организма. Хотя белковый метаболизм происходит здесь несколько медленнее, чем в других тканях, мышечный белок представляет собой самый большой эндогенный аминокислотный резерв, который при голодании может использоваться для глюконеогенеза.
Мышцы являются основной мишенью воздействия инсулина: здесь под его влиянием усиливается поступление аминокислот, увеличивается синтез мышечного белка и снижается распад.
В процессе превращений в мышцах образуются аланин и глутамин, их условно можно считать транспортными формами азота. Аланин непосредственно из мышц попадает в печень, а глутамин вначале поступает в кишечник, где частично превращается в аланин. Поскольку в печени из аланина происходит синтез глюкозы, частично обеспечивающий мышцу энергией, получающийся круго- оборот получил название глюкозо- аланинового цикла.
К азотсодержащим веществам мышц также относятся высокоэнергетичный креатин-фосфат и продукт его деградации креатинин. Экскреция креатинина обычно рассматривается как мера мышечной массы. Однако это соединение может поступать в организм с высокобелковой пищей и влиять на результаты исследования содержания его в моче. Продукт распада миофибриллярных белков — 3-метилгистидин — экскретируется с мочой в течение короткого времени и является достаточно точным показателем скорости распада в мышцах — при мышечном истощении скорость его выхода пропорционально снижается.
Механизм голодания
В отсутствие пищи синтез альбумина и мышечного белка замедляется, но продолжается деградация аминокислот. Поэтому на начальном этапе голодания мышцы теряют аминокислоты, которые идут на энергетические нужды. В дальнейшем организм адаптируется к отсутствию новых поступлений аминокислот (снижается потребность в зависящем от белка глюконеогенезе за счет использования энергетического потенциала кетоновых тел) и потеря белка мускулатуры уменьшается.
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!
Роль почек
Почки не только выводят конечные продукты азотного распада (мочевину, креатинин и др.), но и являются дополнительным местом ресинтеза глюкозы из аминокислот, а также регулируют образование аммиака, компенсируя избыток ионов водорода в крови.
Глюконеогенез и функционирование кислотно-щелочной регуляции тесно скоординированы, поскольку субстраты этих процессов появляются при дезаминировании аминокислот: углерод для синтеза глюкозы и азот — для аммиака. Существует даже мнение, что именно производство глюкозы является основной реакцией почек на ацидоз, а образование аммиака происходит вторично.
Белок в нервной ткани
Для нервной ткани характерны более высокие концентрации аминокислот, чем в плазме. Это позволяет обеспечить мозг достаточным количеством ароматических аминокислот, являющихся предшественниками нейромедиаторов.
Некоторые заменимые аминокислоты, такие как глутамат (из которого при участии пиридоксина образуется гамма-аминомасляная кислота) и аспартат, также обладают влиянием на возбудимость нервной ткани. Их концентрация здесь высока, при этом заменимые аминокислоты способны синтезироваться и на месте.
Сон после еды
Специфическую роль играет триптофан, являющийся предшественником серотонина. Именно с повышением концентрации триптофана (а следовательно, и серотонина) связана сонливость после еды. Такой эффект особенно выражен при приеме больших количеств триптофана совместно с углеводистой пищей. Повышенная секреция инсулина снижает уровень в крови аминокислот с ветвящимися цепями, которые при преодолении барьера «кровь — мозг» обладают конкурентными взаимоотношениями с ароматическими аминокислотами, но в то же время не оказывает влияния на концентрацию связанного с альбумином триптофана. Благодаря подобным эффектам препараты триптофана могут использоваться в психиатрической практике.
При заболеваниях печени
Ограничение ароматических аминокислот в рационе, в связи с их влиянием на центральную нервную систему, имеет профилактическое значение при ведении пациентов с печеночной энцефалопатией. Элементные аминокислотные диеты с преимущественным содержанием лейцина, изолейцина, валина и аргинина помогают избежать развития белковой недостаточности у гепатологических больных и в то же время не приводят к возникновению печеночной комы.
Основные пластические функции протеиногенных аминокислот перечислены в таблице 2.
Таблица 2. Основные функции аминокислот
| Аланин | Предшественник глюконеогенеза, переносчик азота из периферических тканей в печень |
| Аргинин | Непосредственный предшественник мочевины |
| Аспарагиновая кислота | Предшественник глюконеогенеза, предшественник пиримидина, используется для синтеза мочевины |
| Глутаминовая кислота | Донор аминогрупп для многих реакций, переносчик азота (проникает через мембраны легче, чем глутамин), источник аммиака, предшественник ГАМК |
| Глицин | Предшественник пуринов, глютатиона и креатинина, входит в состав гемоглобина и цитохромов, нейротрансмиттер |
| Гистидин | Предшественник гистамина, донор углерода |
| Лизин | Предшественник карнитина (транспорт жирных кислот), составляющая коллагена |
| Метионин | Донор метальных групп для многих синтетических процессов (в т. ч. холина, пиримидинов), предшественник цистеина, участвует в метаболизме никотиновой кислоты и гистамина |
| Фенилаланин | Предшественник тирозина |
| Серин | Составляющая фосфолипидов, предшественник сфинголипидов, предшественник этаноламина и холина, участвует в синтезе пуринов и пиримидинов |
| Триптофан | Предшественник серотонина и никотинамида |
| Тирозин | Предшественник катехоламинов, допамина, меланина, тироксина |
| Цистеин | Предшественник таурина (желчные кислоты), входит в состав глютатиона (антиоксидантная система) |
Нормы потребления белка
Современные рекомендации по обеспечению пожилых людей и стариков основными питательными веществами, в первую очередь белками, свидетельствуют о целесообразном некотором снижении суточного количества белковых продуктов в пищевом рационе до 0,75–0,8 г/кг веса. Это связано с тем, что интенсивность основных физиологических функций с каждым десятилетием жизни человека после 50 лет снижается почти на 10 % (Rogers J., Jensen G., 2004), потребность белка уменьшается за счет инволюции синтетических и пластических процессов и ферментообразования, продукции гормонов, ряда биологически активных веществ, обеспечения мышечной деятельности и т. д.
Рекомендуемые нормы потребления для белка с учетом приведенных выше показателей составляют 55–62 г/сут (для мужчины весом 77 кг в возрасте 60–70 лет) и 45–52 г/сут (для женщины весом 65 кг в возрасте 60–70 лет) по выводам IV Американского национального исследования по оценке здоровья и питания (2006).
Вместе с тем установлено, что при сохранении физической активности пожилых людей (профессиональной физической нагрузки, занятий физкультурой, работы на дачном участке и т. п.) для поддержания азотного равновесия организма требуется повышение белкового обеспечения пожилого человека в количестве 1–1,25 г/кг в день. Эта же квота пищевого белка полностью обеспечит потребности пожилого человека, находящегося в состоянии стресса, болезни или ранения (Lowenthal D. T., 1990).
Рис. 1. Влияние пищевых веществ на развитие болезней избыточного питания (по А. А. Покровскому)
Дефицит белка = старение
Важно отметить, что организм пожилого человека очень чувствителен как к дефициту экзогенно поступающих белков, так и к их избытку. В условиях белкового дефицита прогрессирующе развиваются процессы дистрофии и атрофии клеточных структур, в первую очередь мышечной ткани, слизистых оболочек (желудочно-кишечного тракта, дыхательной системы и др.), паренхиматозных органов (поджелудочной железы, печени, эндокринных желез и др.), структур иммунной системы. Белковый дефицит питания активизирует процессы старения организма.
Механизмы патологического действия на организм пожилого и старого человека пищевой белковой перегрузки связаны в первую очередь с белковой «агрессией» печени и связанной с этим несостоятельностью ферментных систем, неполной деполимеризацией всех фракций белка, накоплением в крови токсических продуктов незавершенных окислительно-восстановительных реакций и т. д.
Белковая перегрузка
Интоксикационный процесс метаболического генеза при избыточном белковом питании пожилых и старых людей многократно усиливается по причине развития процессов гнилостной кишечной диспепсии в условиях относительной ферментной недостаточности желудка, поджелудочной железы, тонкой кишки и развития синдромов мальдигестии и мальабсорбции, а также кишечного дисбиоза (Барановский А. Ю., Кондрашина Э. А., 2008).
Белковая пищевая перегрузка в рамках интоксикационного синдрома способствует перевозбуждению центральной нервной системы, иногда — состояниям, близким к неврозам. При этом наблюдается повышенный расход витаминов в организме с формированием витаминной недостаточности.
При длительном высокобелковом питании вначале наблюдается компенсаторное усиление, а затем угнетение секреторной функции желудка и поджелудочной железы, повышается риск развития таких заболеваний, как подагра, мочекаменная болезнь.
В следующем выпуске журнала «Практическая диетология» мы продолжим рассказ о геронтологических особенностях основных видов обмена веществ пациентов пожилого и старческого возраста — углеводном и жировом обмене.
// ПД
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!







