с чем реагирует каустическая сода
Гидроксид натрия: способы получения и химические свойства
Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
Способы получения
1. Гидроксид натрия получают электролизом раствора хлорида натрия :
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Качественная реакция
Химические свойства
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия:
Сера взаимодействует с гидроксидом натрия только при нагревании:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксид натрия разлагается при нагревании до температуры 600°С:
2NaOH → Na2O + H2O
NaOH ↔ Na + + OH —
4NaOH → 4Na + O2 + 2H2O
Взаимодействие каустика с различными химическими составами
Взаимодействие каустика с различными химическими составами
Каустическая сода– это вещество белого цвета и без ярко выраженного запаха. Химическая формула – NaOH, говорит о составе вещества. Способен быстро нейтрализовать засоры, избавить от жировых отложений, грязи, удалить пятна на ткани, а также используется в составе косметики (шампунь, крема).
Физические характеристики
Щелочь едкий натр, по сравнению с другими веществами данной группы (кальцинированная сода и карбонат калия) обладает очень высокой активностью и концентрацией, что может вызвать сильнейшие ожоги. Он поглощает влагу из воздуха и разъедает многие материалы и органические вещества (бумагу, металлы, воду), растворяется в воде, этиловом и метиловом спиртах.
Взаимодействие каустика с химическими веществами
По своим химическим свойствам едкий натр это кислота, которая является сильным химическим основанием, способным взаимодействовать с различными элементами. В конце реакций получают множество новых полезных веществ необходимых для последующих реакций:
Едкий натр и соляная кислота в процессе реакции: NaOH + HCl = 2NaOH + 2HCl = 2NaCl + H2O объединяются в нейтральную малодиссоциированную молекулу воды, в результате происходит реакция нейтрализации. При реакции серная кислота и едкий натр образуется сульфат натрия, который используется для изготовления мыла, окрашивания текстиля и в нефтеперерабатывающей промышленности. Едкий натр способен взаимодействовать с различными химическими элементами в любых агрегатных состояниях (жидком, твердом, газообразном).
Азотная кислота с едким натром в результате взаимодействия образуют нитрат натрия, который применяется в производстве стекла, а в медицине – в качестве сосудорасширяющего средства, как бронхолитическое и слабительное.
В реакции едкий натр и сероводород получается средняя соль – при 2NaOH и кислая соль, если пропорция составляет 1к1.
При взаимодействии хлора и едкого натра образуется гипохлорит натрия, который применяется в качестве обеззараживания воды, как антисептик и окислитель.
Для нейтрализации каустической соды нужно использовать раствор уксусной или лимонной кислоты, в случае отсутствия можно применить раствор борной кислоты.
Химические методы получения гидроксида натрия
Каустическая сода в воде растворяется и выделяет большое количество тепла. В настоящее время известны три способа, с помощью которых можно получить гидроксид натрия. К ним относятся пиролитический, известковый и ферритный методы получения, но из-за существенных недостатков они были заменены на более эффективные электрохимические. При пиролитическом методе в качестве продуктов используются гидрокарбонат натрия, который в результате реакции разлагается на три главных химических продукта: карбонат натрия воду и углекислый газ после этого полученное вещество размещают в специальные холодильные камеры и добавляют воду.
При известковом методе получения в качестве сырья используется сода и гашеная известь, при соблюдении определенной температуры, которая составляет 80 градусов. В конечном итоге, мы получаем два вещества: гидроксид натрия и осадок карбоната кальция, который отделяем с помощью фильтрации. Сам же едкий натр плавится и разливается в железные контейнеры, где происходит его дальнейшая кристаллизация. При ферритном методе идет процессы спекания кальцинированной соды с окисью железа при температуре около 900 градусов. В конечном итоге гидроксид натрия получится при обработке спекой воды, а после этого его упаривают, после чего субстанция приобретает конечный кристаллизованный вид.
Осторожность при использовании
Следует помнить о том, что щелочь едкий натр является активной и опасной и для того, чтобы избежать серьезных травм в процессе работы, необходимо соблюдать меры безопасности, которые предусмотрены для работы с химическими веществами. Обязательно пользоваться средствами индивидуальной защиты: комбинезон, перчатки, очки. При попадании ядовитого вещества на кожу, необходимо незамедлительно промыть под проточной водой и обратиться за помощью в медицинское учреждение. При работе с едким натром необходимо одевать средства защиты глаз, а при их отсутствии внимательно следить за тем, чтобы субстанция не попала в глаза, так как это может привести к потере зрения. Ни в коем случае нельзя глотать или вдыхать (если субстанция жидкая), так как это может вызвать ожоги слизистой оболочки дыхательных путей, пищевода или гортани. Если все же попало в рот вещество, то необходимо прополоскать обильным количеством воды и обратиться за помощью к врачу.
Купить каустическую соду оптом
Завод Базис является поставщиком импортной каустической соды в Россию уже несколько лет. Наш успешный опыт показал, что каустик из зарубежа может являться отличной альтернативой отечественному.
Едкий натр
каустическая сода,
едкая щелочь
— 52,2 (20 °C) г/100 мл
Гидроксид натрия лат. Natrii hydroxidum ; другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь. Самая распространенная щёлочь, химическая формула NaOH. В год в мире производится и потребляется более 57 миллионов тонн едкой щёлочи. Гидроксид натрия также используется для мойки пресс-форм автопокрышек, называется Mold Cleaner фирмы «NALCO». Интересна история тривиальных названий как гидроксида натрия, так и других щелочей, название «едкая щёлочь» обусловлено свойством разьедать кожу, бумагу, стекло и вызывать сильные ожоги. До XVII века, щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой (по растению Salsola Soda, из золы которого её добывали), а карбонат калия — поташем. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Содержание
Физические свойства
ΔH 0 растворения для бесконечно разбавленного водного раствора —44,45 кДж/моль.
Из водных растворов при 12,3 — 61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH 0 обр −734,96 кДж/моль), в интервале от —28 до —24°С — гептагидрат, от —24 до —17,7°С — пентагидрат, от —17,7 до —5,4°С —тетрагидрат (α-модификация), от —5,4 до 12,3 °C. Растворимость в метаноле 23,6 г/л (t=28 °C), в этаноле 14,7 г/л (t=28 °C). NaOH·3,5Н2О (температура плавления 15,5 °C);
Химические свойства
Гидроксид натрия (едкая щёлочь)— сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочно-земельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкий калий), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдает электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в ряду электрохимической активности металлов, в котором за ноль принята активность водорода.
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твердых веществ:
так и с растворами:
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
2. Обмена с солями в растворе:
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе. Его и используют, в частности, для очистки воды от мелких взвесей.
например, с фосфором — с образованием гипофосфита натрия:
4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
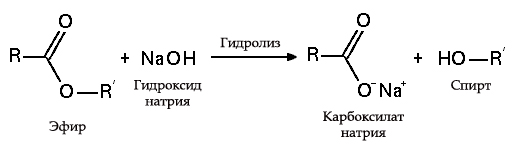
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира.
6. С многоатомными спиртами — с образованием алкоголятов:
7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов):
Качественное определение ионов натрия возможно несколькими способами
1. По цвету пламени горелки — ионы натрия придают пламени жёлтую окраску:
2. С использованием специфических реакций на ионы натрия:
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро- | ||
|---|---|---|---|---|---|---|---|
| Цвет осадка | белый | бледно-жёлтый | жёлто-зеленый | желто-зеленый | белый | белый | бледно-жёлтый |
Способы получения
Промышленные способы получения
В промышленном масштабе гидроксид натрия получают электролизом растворов галита (каменная соль NaCl) с одновременным получением водорода и хлора:
Едкие щёлочи, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом. Для некоторых производств это важно. Так, в производстве искусственных волокон можно применять только каустик, полученный при электролизе с жидким ртутным катодом. В мировой практике используются все три метода получения хлора и каустика, при явной тенденции в сторону увеличения доли мембранного электролиза. В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Эффективность процесса производства рассчитывается не только по выходу едкого натра, но и по выходу хлора и водорода, получаемых при электролизе, соотношение хлора и гидроксида натрия на выходе 100/110, реакция протекает в следующих соотношениях:
1,8 NaCl + 0, 5 H2O + 2,8 МДж = 1,00 Cl2 + 1,10 NaOH + 0,03 H2,
Основные показатели различных методов производства даны в таблице:
Технологическая схема электролиза с твёрдым катодом
Диафрагменный метод — Полость электролизёра с твёрдым катодом разделена пористой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом [1]. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита. В результате электрохимического процесса на аноде за счет разложения галита выделяется хлор, а на катоде за счет разложения воды — водород. Хлор и водород выводятся из электролизёра раздельно, не смешиваясь:
При этом прикатодная зона обогащается гидроксидом натрия. Раствор из прикатодной зоны, называемый электролитическим щёлоком, содержащий неразложившийся анолит и гидроксид натрия, непрерывно выводится из электролизёра. На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до 42—50 % в соответствии со стандартом. Галит и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или на стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией. Кристаллический галит (обратную соль) возвращают на электролиз, приготавливая из неё так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат. Убыль анолита возмещают добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов или растворением твёрдого галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Мембранный метод — аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной мембраной. Мембранный электролиз обеспечивает получение наиболее чистого каустика.
который отводится из электролизёра, а на ртутном катоде образуется слабый раствор натрия в ртути, так называемая амальгама:
Амальгама непрерывно перетекает из электролизёра в разлагатель. В разлагатель также непрерывно подаётся хорошо очищенная от примесей вода. В нем амальгама натрия в результате самопроизвольного электрохимического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, не содержит примеси галита, вредной в производстве вискозы. Ртуть почти полностью освобождается от амальгамы натрия и возвращается в электролизер. Водород отводится на очистку. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесенные с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают двух- или трёхступенчатым процессом растворённый в нём хлор.
Лабораторные способы получения
В лаборатории гидроксид натрия получают химическими способами, которые имеют больше историческое, чем практическое значение.
В результате реакции образуется раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % NaOH. Расплавленный NaOH разливают в железные барабаны, где он застывает.
Ферритный способ описывается двумя реакциями:
(1) — процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек-феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции (2); получается раствор гидроксида натрия и осадок Fe2O3, который после отделения его от раствора возвращается в процесс. Раствор содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % NaOH.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество топлива, получаемый едкий натр загрязнен примесями, обслуживание аппаратов трудоемко. В настоящее время эти методы почти полностью вытеснены электрохимическим способом производства.
Каустическая сода: ее свойства и применение
Описание средства
Каустическая сода — сильная ядовитая щелочь. Если ее раствор попадет на кожу, то могут возникнуть ожоги, язвы. Она относится ко 2 классу опасности, поэтому при использовании необходимо соблюдать меры предосторожности:
Каустическая сода — продукт химического синтеза, в природе такого вещества не существует. Продается она в хозяйственных магазинах, отделах бытовой химии, расфасована в пластиковые банки или плотные полиэтиленовые мешки весом от 250 г до 30 кг.
Применение
У едкого натра очень широкий спектр применения в различных отраслях производства: текстильной, химической, пищевой, нефтяной и пр. Большая часть стиральных порошков, шампуней, моющих, чистящих средств содержит каустик. Его используют в производстве бумаги, вискозы, оливок, мороженого, какао, шоколада. В пищевой промышленности он известен как пищевая добавка Е524.
В быту основное назначение гидроксида натрия — борьба с жировыми и органическими загрязнениями. Его применяют для чистки канализации, обезжиривания поверхностей, в изготовлении мыла ручным способом, отбеливании и стирке белья, борьбе с садовыми вредителями, для санитарной обработки помещений.
Чистка канализации
Канализационные трубы имеют свойство засоряться: на их внутренней поверхности оседает жир, мыльная пена, органические остатки. Все это спрессовывается, уменьшая просвет трубы, вода плохо уходит, появляется неприятный запах из сливного отверстия. Причины могут быть как технические, так и эксплуатационные:
Перед работой желательно на несколько минут открыть горячую воду для того, чтобы канализационная система прогрелась, и загрязнения лучше поддавались обработке щелочью. Для очистки канализации от жировых и органических загрязнений с помощью каустической соды существует несколько методов:
Раствор гидроксида натрия используют в качестве профилактического средства 1 раз в 3 месяца для промывки труб от накопившихся частичек жира и органических загрязнений.
Чистка выгребных ям
В выгребные ямы на даче или в частном доме сливаются все нечистоты. Большая их часть имеет жидкую фракцию, которая уходит через земляные стенки, а густая скапливается на дне и по мере необходимости удаляется.
Очень часто стенки выгребных ям покрываются плотной органической пленкой, вода перестает уходить. В результате канализационные отходы быстро переполняют яму. Для растворения пленки и очистки земляных стенок используют каустическую соду. Количество ее берут из расчета 4 кг на 1 кубометр выгребной ямы. Предварительно растворив соду в воде, аккуратно выливают раствор едкой щелочи в яму. Эффект наступает через 2-3 дня. Пленка постепенно растворяется, уровень жидкости уменьшается, на дне остается илистый осадок.
Очистка загрязненных поверхностей
Каустическая сода применяется для чистки эмалированных раковин, поверхностей плит, сильнозагрязненной кухонной посуды от жира, копоти, нагара. Для этого нужно смешать ее с жидким моющим средством или со стиральным порошком, развести водой до консистенции пасты, нанести на поверхность. Через 20–30 минут смыть большим количеством воды.
Использовать каустическую соду на оцинкованных, алюминиевых и тефлоновых поверхностях нельзя. Их можно испортить.
Стирка белья
Раствор каустика используют для замачивания, ручной и машинной стирки хлопчатобумажного, льняного белья. При добавлении щелочи вода становится мягкой, пятна хорошо удаляются, особенно с кухонных полотенец. Раствор готовят следующим образом: в 5 л воды нужно развести 3 ст. л. NaOH. Замочить белье на 1–2 часа. После этого постирать обычным порошком.
При стирке белья в стиральной машине к порошку добавляют 2–3 ложки каустической соды. Пятна, даже застарелые, легко отстирываются. Перед стиркой белье желательно замочить, стирать при температуре 40–60°С.
Изделия из шелковых и шерстяных тканей стирать с помощью щелочи не рекомендуется, она может повредить их структуру.
Изготовление мыла
Способов изготовления домашнего мыла с помощью каустической соды множество. Необходимые ингредиенты:
1 л любого растительного масла;
300 мл дистиллированной воды;
эфирные ароматические масла;
порошки, настои различных трав.
Через 4-5 дней можно вынуть мыло из формочек, дать ему»дозреть» и подсохнуть. На это понадобится время (иногда несколько недель). Признаком готовности мыла считается появление на его поверхности белого порошкообразного налета.
Борьба с вредителями и болезнями растений
Гидроксид натрия применяют в борьбе с садовыми вредителями и болезнями растений, для обеззараживания овощехранилищ, амбаров, клеток для животных, теплиц.
Для обработки растений делают раствор: в 2 л воды добавляют 1 ложку каустика, тщательно размешивают, опрыскивают деревья и кустарники. Это помогает избавиться от тли, долгоносика, грибковых поражений: фитофтороза, мучнистой росы.
Для обеззараживания помещений используют 4%-ный раствор NaOH. Для этого берут 10 ст. л.соды растворяют в 5 л воды и несколько раз обрабатывают зараженные поверхности.