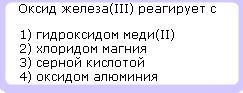
с чем реагируют оксиды неметаллов
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А10 ГИА (ОГЭ) по химии —
Химические свойства оксидов: основных, амфотерных, кислотных
Классификация оксидов:
Оксиды, образованные металлами
Оксиды, образованные неметаллами
Основные
Кислотные
Несолеобразующие
— Na2O, CaO;
оксиды d-элементов в низших с.о. — CrO, FeO
d-элементы в средней с.о. — Cr2O3, Fe2O3, MnO2
1) оксиды неметаллов в высших и средних степенях окисления
CO2, N2O3, N2O5, SO3, SO2
2) оксиды d-элементов в высшей с.о.:
оксиды неметаллов в промежуточных степенях окисления:
Химические свойства основных оксидов:
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей:
1. Окисление кислородом:
если металл — d-элемент и «ему есть до чего окисляться»: 2FeO + O2 = Fe2O3
2. Взаимодействие с неметаллами:
2Na2O + S = 4Na + SO2
Fe2O3 + C = 2FeO + CO
3. Восстановление — реакции с водородом:
4. Образование солей с кислотными оксидами:
CaO + CO2 = CaCO3 (соль)
5. Взаимодействие с кислотами:
BaO + 2HNO3 = Ba(NO3)2 (соль) + H2O
Химические свойства амофтерных оксидов:
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли
при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами).
1. Взаимодействие в растворе(!) с щелочами:
Al2O3 + 2H2O + 2NaOH = 2Na[Al(OH)4] + 3H2
2. Образование солей с кислотами:
ZnO + H2SO4 = ZnSO4 + H2O
Химические свойства кислотных оксидов:
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Реакция с водой: образование кислот:
1. + O2
если элемент, образующий оксид в средней с.о.:
2. + H2
восстановление до несолеобразующего оксида или простого вещества:
3. + вещества. образованные металлами:
SO2 + CaO = CaSO3 (соль)
SO2 + 2LiOH = Li2SO3 + H2O
Химические свойства несолеобразующих оксидов
здесь все просто — они только
окисляются до кислотных и восстанавливаются до простых веществ:
Химия. 11 класс
Конспект урока
Урок № 15. Свойства оксидов неметаллов. Свойства серной и азотной кислот. Водородные соединения неметаллов
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению соединений неметаллов: оксидам неметаллов, кислородсодержащим кислотам и водородным соединениям неметаллов.
Аммиак – NH3 – бинарное химическое соединение азота с водородом, бесцветный токсичный газ с резким характерным запахом, 10%-ный раствор аммиака используют в медицине, называют нашатырным спиртом.
Высшие оксиды – оксиды, в которых элементы проявляют свою наибольшую валентность
Серная кислота – H2SO4 – сильная двухосновная кислота. При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O 1 — раствор SO3 в серной кислоте (олеум). Мировое производство серной кислоты около 200 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений.
Сернистый газ – SO2 – оксид серы IV. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Токсичен. Один из основных компонентов вулканических газов.
Серный газ – SO3 – оксид серы VI. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. Весьма токсичен. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Сероводород – SH2 – бинарное химическое соединение водорода и серы. Бесцветный газ со сладковатым вкусом, обеспечивающий запах протухших куриных яиц.
Угарный газ – CO – монооксид углерода, оксид углерода II, бесцветный чрезвычайно токсичный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей. Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом.
Углекислый газ – CO2 – диоксид углерода, оксид углерода IV, бесцветный газ, почти без запаха, но в больших концентрациях приобретает кисловатый запах, знакомый нам по газировке. Является одним из парниковых газов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Соединения неметаллов с кислородом и водородом
Неметаллы (углерод, кислород, азот, сера, галогены) могут образовывать соединения как с кислородом (оксиды), так и с водородом. Водородные соединения являются газами или жидкостями, например, вода, аммиак, сероводород, соляная кислота. Оксиды могут быть газами (углекислый или сернистый газ), жидкостями (оксид хлора(VI) и (VIII)) или твёрдыми телами (оксид фосфора(V)).
Типичными примерами оксидов неметаллов являются:
Сернистый газ (SO2), серный газ (SO3), угарный газ (CO), углекислый газ (CO2), оксид фосфора V (P2O5), оксид азота I (NO), оксид азота II (NO2).
Оксиды неметаллов подразделяют на две группы – несолеобразующие (SiO, N2O, NO, CO, S2O, H2O) и солеобразующие (остальные).
Несолеобразующих оксидов немного, их обыкновенно образуют одновалентные и двухвалентные неметаллы.
Высшие оксиды – это оксиды, в которых неметалл проявляет степень окисления, равную номеру группы.
Кислотные свойства оксидов. В пределах одного периода с увеличением номера группы наблюдается увеличение кислотных свойств высших оксидов и соответствующих им кислот. Например, для неметаллов третьего периода, кремниевая кислота является слабой, а хлорная кислота является одной из самых сильных.
Такая закономерность вытекает из периодического закона Менделеева. В периоде радиус атома неметалла уменьшается с увеличением номера группы, а заряд неметалла при этом увеличивается. Поэтому при движении по периоду слева направо связь между неметаллом и кислородом упрочняется, а связь неметалл-водород ослабевает, что даёт увеличение диссоциации кислоты.
В пределах одной главной подгруппы происходит ослабление кислотных свойств оксидов и кислот с увеличением номера периода.
Соединения неметаллов с водородом
В периодах слева направо кислотные свойства водородных соединений неметаллов в водных растворах усиливаются. Это связано с тем, что в этом направлении у атомов элементов увеличивается заряд ядра и уменьшается радиус.
В группах сверху вниз, по мере увеличения атомного радиуса, отрицательно заряженные анионы неметаллов всё слабее притягивают положительно заряженные ионы водорода. Таким образом, отщепление ионов водорода происходит проще и кислотность увеличивается.
Некоторые из рассматриваемых соединений при взаимодействии с водой образуют кислородосодержащие кислоты, такие как серная, азотная, фосфорная кислоты.
Азотная кислота также относится к кислородосодержащим кислотам, но не образуется при растворении соответствующих оксидов в воде. Для синтеза этой кислоты требуется более сложный процесс: смесь оксидов азота реагируют с водой с поглощением кислорода.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
Оксид с формулой XO2 прореагировал с 14 г CaO (оксид неметалла был взят в избытке), при этом образовалось 30 г соли CaXO3.
1) Укажите порядковый номер элемента X.
2) Какая масса (в граммах) оксида неметалла прореагировала?
3) Укажите степень окисления неметалла в оксиде XO2 (без знака)
4) Укажите максимальную степень окисления элемента X (без знака)
Составим уравнение реакции оксида неметалла с основным оксидом:
Стехиометрическое соотношение CaO к CaXO3 – 1:1
Определим количество вещества CaO: M(CaO) = 56 г/моль. Количество вещества n = m/M. n(CaO) = 14/56 = 0,25 моль.
Определим молярную массу элемента X. Поскольку стехиометрическое соотношение CaO к CaXO3 – 1:1, то n(CaXO3) = 0,25 моль. Определим молярную массу соединения CaXO3. M = m/n. M(CaXO3) = 30/0,25 = 120 г/моль. Молярная масса CaXO3 слладывается из атомарных масс образующих соединение элементов. Получаем уравнение:
Определяем элемент X. Находим в таблице Менделеева элемент с молярной массой 32 г/моль. Это сера, элемент с порядковым номером 16.
Определяем массу прореагировавшего XO2. Исходя из материального баланса:
m(CaO) и m(CaXO3) известны из условия задачи. Определяем m(XO2).
m(XO2) = 30 – 14 = 16 г.
Определяем максимальную степень окисления элемента X (без знака). Мы определили, что элемент X – это сера. Максимальную степень окисления элементы проявляют в высших оксидах. Высший оксид для серы это SO3. Степень окисления серы в нём = +6. Без знака: 6.
Порядковый номер элемента X – 16. Это сера.
m(XO2) = 16 г. Степень окисления неметалла в оксиде XO2 (без знака): 4. Максимальную степень окисления элемента X (без знака): 6.
Соедините между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
Определим среди предложенных соединений оксиды неметаллов. Это Cl2O, SO2, SO3, CO2. Остальные соединения не являются оксидами.
Определим соответствующие им кислоты. Такие кислоты получаются при взаимодействии оксидов с водой:
Соединяем между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
Химические свойства неметаллов
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов:
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием.
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом.
1.6. Водород горит, взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов. Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например, водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов.
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Cl2 + H2O ↔ HCl + HClO
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Химические свойства кислорода
ри нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1.1. При горении серы на воздухе образуется оксид серы (IV) :
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
S + Fe → FeS
S + Hg → HgS
Еще пример : алюминий взаимодействует с серой с образованием сульфида алюминия:
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Серная кислота также окисляет серу. Но, поскольку S +6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
При взаимодействии с перегретым паром сера диспропорционирует:
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000 о С), на электрической дуге (в природе – во время грозы) :
Процесс эндотермический, т.е. протекает с поглощением теплоты.
2С + N2 → N≡C–C≡N
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Серная кислота также окисляет фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Или с гидроксидом кальция:
Химические свойства углерода
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
2C + Ca → CaC2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C 0 + H2 + O → C +2 O + H2 0
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
3С + СаО → СаС2 + СО
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
Химические свойства кремния
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O