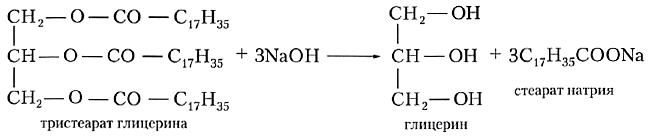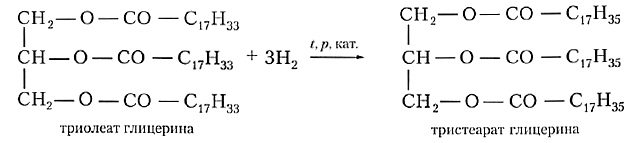с чем реагируют сложные эфиры
Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, химические и физические свойства, строение.
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
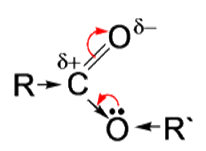
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
При щелочном гидролизе этилацетата образуются ацетат и этанол:
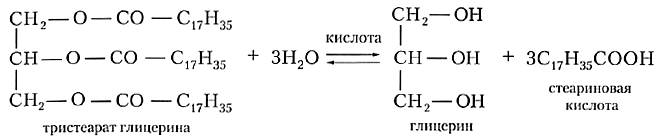
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Получение сложных эфиров
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
| Например, при взаимодействии ацетата натрия с хлорметаном образуется метилацетат. |
CH3-COONa + CH3-Cl = CH3-COOH + NaCl
Сложные эфиры
Характеристики и физические свойства сложных эфиров
Рис. 1. Строение молекулы сложного эфира.
Сложные эфиры низших карбоновых кислот и простейших спиртов – это летучие жидкости, плохо растворяющиеся в воде, обычно имеющие приятный запах, легче воды (например, плотность изоамилацетата – 0,876 г/см 3 ).
Сложные эфиры высших спиртов и карбоновых кислот – твердые, воскоподобные, напримерпальмитиновоцетиловый эфир (содержится в спермацете – одной из нуклеиновых кислот, участвующих в передаче наследственных признаков) и пальмитиновомирициловый эфир (содержится в пчелином воске).
Получение сложных эфиров
Основные способы получения сложных эфиров – это:
— взаимодействие кислот со спиртами
— взаимодействие ангидридов карбоновых кислот со спиртами
Химические свойства сложных эфиров
Химические свойства сложных эфиров обусловлены наличием функциональной группы. Наиболее важной является реакция гидролиза:
Сложные эфиры вступают в реакции взаимодействия со следующими веществами:
— спиртами (реакция переэтерификации)
— галогенирования, если в составе углеводородного радикала имеются кратные связи
Применение сложных эфиров
Сложные эфиры применяются для изготовления искусственных эссенций, используемых в производстве фруктовых вод, кондитерских изделий, косметических средств, отдушек для препаратов бытовой химии и т.д.
Примеры решения задач
| Задание | Какая масса метанола образуется при гидролизе метилацетата, массой 10 г? |
| Решение | Запишем уравнение гидролиза метилового эфира уксусной кислоты: |
Определим количество вещества метилацетата, используя значение его массы из условия задачи (молярная масса – 84 г/моль):
По уравнению n (CH3— C(O)O- CH3) = n (CH3OH) =0,12 моль. Рассчитаем массу метанола (молярная масса – 32 г/моль):
| Задание | Определите массу уксусной кислоты, которую можно получить в ходе реакции омыления этилацетата массой 180 г. |
| Решение | Запишем уравнение реакции гидролиза этилового эфира уксусной кислоты используя брутто формулы: |
Рассчитаем количество вещества этилацетата (молярная масса – 88 г/моль), используя значение массы из условий задачи:
Согласно уравнению реакции, число моль этилацетата и уксусной кислоты равны:
Тогда, можно определить массу уксусной кислоты (молярная масса – 60 г/моль):
m(CH3COOH)= n (CH3COOH) × M (CH3COOH) = 2 × 60 = 120 г.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Сложные эфиры.
Сложные эфиры – соединения, у которых атом водорода замещен углеводородным радикалом. Общая формула:
Изомерия сложных эфиров.
Для сложных эфиров характерны следующие виды изомерии: изомерия углеродной цепи, изомерия положения сложноэфирной группировки –СО-О-, межклассовая изомерия:
Физические свойства сложных эфиров.
Сложные эфиры представляют собой летучие, малорастворимые и практически нерастворимые в воде жидкости. Многие имеют приятный запах.
Сложные эфиры имеют более низкую температуру кипения, чем соответствующие кислоты. Сложные эфиры высших жирных кислот и спиртов – воскообразные вещества, не имеют запаха и нерастворимы в воде, но хорошо растворимы в органических растворителях.
Химические свойства сложных эфиров.
1. Реакция гидролиза (омыления).
Гидролиз ускоряется под действием щелочей, и гидролиз необратим:
3. Реакция восстановления:
4. Реакция образования амидов.
Реакция этерификация сложных эфиров.
Свойства сложных эфиров (химические)

Всего получено оценок: 124.
Всего получено оценок: 124.
Сложные эфиры являются производными карбоновых или неорганических кислот, в молекуле которых атом водорода в гидроксильной группе замещён радикалом. Такое строение обуславливает химические свойства сложных эфиров.
Сложные эфиры карбоновых кислот делятся на три общие группы:
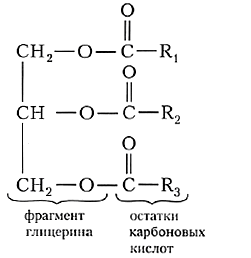
Привычные в быту масла – смеси, состоящие из глицерина и остатков различных жирных кислот.
Получение
Сложные эфиры получают с помощью реакции этерификации из спиртов и карбоновых кислот:
Это наиболее важная реакция, которая обратима в ряде случаев: взаимодействуя с водой, образованный сложный эфир вновь распадается на начальные вещества.
Также сложные эфиры получают взаимодействием:
При реакции этерификации от молекулы спирта отщепляется атом водорода, от кислоты – гидроксил.
Химические свойства
Реакция
Описание
Уравнение
Обратная реакция этерификации – расщепление в водной среде на спирт и кислоту. При нагревании с водой в кислой среде разлагаются на кислоту и спирт. Эфиры «омыляются» под действием раствора щёлочи, образуя органическую соль и спирт. В этом случае реакция необратима
При присоединении водорода сложные спирты восстанавливаются до спиртов
Реакция возможна при наличии в молекуле двойных связей. Атомы галогенов присоединяются к местам разрыва связей
СН3СООСН=СН2 (виниловый эфир уксусной кислоты) + Br2 → Br-CH2-C H(Br)-COOH-CH2
CH3-COO-CH3 (метилацетат) + NH3 → CH3-C(NH2)=O (амид уксусной кислоты) + CH3-OH (метанол)
При полном сгорании образуется углекислый газ и вода
Сложные эфиры применяются в качестве ароматизаторов в медицине, парфюмерии, пищевой промышленности. Они входят в состав ягод, фруктов, пчелиного воска.
Что мы узнали?
С чем реагируют сложные эфиры
Процесс получения сложных эфиров носит название реакции этерификации. Эта реакция с использованием общих формул описывается уравнением
Именно реакцией этерификации в 1759 г. в результате взаимодействия уксусной кислоты с этиловым спиртом был получен первый сложный эфир — этиловый эфир уксусной кислоты:
Обратите внимание на то, как строится название сложного эфира. Оно состоит из четырёх слов, указывающих на название углеводородного радикала и исходной кислоты. Например, продукт взаимодействия муравьиной кислоты с метиловым спиртом — метиловый эфир муравьиной кислоты:
Катион водорода в схеме реакции указывает на то, что реакция этерификации протекает в присутствии кислоты в качестве катализатора.
Сложные эфиры с небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с характерным, часто приятным запахом. Они нерастворимы в воде, но прекрасно растворяют различные органические вещества.
Реакции этерификации обратимы. В присутствии кислот сложные эфиры разлагаются водой — гидролизуются, что можно рассматривать как реакцию, обратную их получению:
В присутствии щелочей гидролиз сложных эфиров необратим, так как образующаяся кислота связывается щёлочью с образованием соли, неспособной вступать в реакцию со спиртом:
Нахождение в природе и применение сложных эфиров
Сложные эфиры широко распространены в природе. Неповторимый аромат цветов и фруктов часто обусловлен присутствием веществ именно этого класса. Сложные эфиры с большой молекулярной массой представляют собой твёрдые вещества — воски. Пчелиный воск — это смесь сложных эфиров, образованных карбоновыми кислотами и спиртами с длинными углеводородными цепями.
Синтетические сложные эфиры используют в пищевой промышленности в качестве добавок для придания фруктовых запахов напиткам и кондитерским изделиям. Благодаря хорошей растворяющей способности сложные эфиры входят в состав растворителей лаков и красок.
Жиры, их строение и свойства
Люди стали использовать жиры в повседневной жизни значительно раньше, чем задумались об их химическом строении. Животные и растительные жиры — важные компоненты пищи. Жиры необходимы для построения клеточных мембран и как источник энергии, поскольку калорийность жиров в 2 раза выше, чем других питательных веществ — углеводов и белков. У позвоночных животных жиры откладываются в жировой ткани, сосредоточенной в основном в подкожной жировой клетчатке и сальнике. В растениях жиры содержатся в сравнительно небольших количествах, за исключением семян масличных растений, в которых содержание жиров может быть более 50%.
Жиры используют не только в пищевой промышленности. Их используют в качестве смазки, косметических и лекарственных средств, для приготовления масляных красок и олифы.
В 1779 г. шведский химик К. Шееле получил из оливкового масла вязкую жидкость, сладкую на вкус, — простейший трёхатомный спирт глицерин. Вскоре выяснилось, что глицерин входит в состав молекул любых жиров. Позднее французский химик М. Шеврёль доказал, что, помимо глицерина, при нагревании жиров в присутствии кислоты образуются и карбоновые кислоты.
| Жиры представляют собой сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот. |
Общую формулу жиров можно представить в следующем виде:
В состав жиров чаще всего входят остатки карбоновых кислот, содержащих чётное число атомов углерода и неразветвлённую углеродную цепь. Наиболее часто в составе жиров встречаются остатки пальмитиновой, стеариновой и олеиновой кислот. В одной молекуле кислотные остатки могут быть различными, поэтому в общей формуле жиров углеводородные радикалы R обозначены разными цифрами.
Сравните состав стеариновой (С17Н35СООН) и олеиновой (С17Н33СООН) кислот. У стеариновой кислоты углеводородный радикал отвечает формуле СnН2n+1, т. е. является предельным. Следовательно, стеариновая кислота относится к предельным карбоновым кислотам. В углеводородном радикале олеиновой кислоты на два атома водорода меньше, поскольку в нём содержится одна двойная углерод-углеродная связь. Олеиновая кислота относится к непредельным карбоновым кислотам.
Жиры животного происхождения имеют твёрдую консистенцию (есть и исключения, например жидкий рыбий жир). В состав молекул твёрдых жиров входят остатки предельных кислот. Растительные жиры, которые часто называют растительными маслами, образованы остатками непредельных кислот, имеют жидкую консистенцию (исключение — твёрдое пальмовое масло). Кстати, название олеиновой кислоты произошло от латинского слова oleum — масло.
Жиры гидрофобны, т. е. нерастворимы в воде, но хорошо растворяются в органических растворителях: этиловом спирте, гексане, тетрахлорметане.
Жиры проявляют все характерные для сложных эфиров химические свойства. Главное из них — это гидролиз. Молекулы воды атакуют связи между кислотным остатком и фрагментом глицерина, в результате чего происходит распад молекулы жира:
Для жира, образованного стеариновой кислотой (такое вещество называют тристеаратом глицерина), уравнение реакции гидролиза выглядит следующим образом:
В качестве катализатора гидролиза жиров выступают кислоты. Такой гидролиз так и называют — кислотный гидролиз. Жирные руки трудно отмыть холодной водой, но стоит только протереть их ломтиком лимона, как они становятся заметно чище. Даже при таком непродолжительном контакте с лимонной кислотой жир частично гидролизуется.
Гидролиз жиров в присутствии щелочей называют щелочным гидролизом:
Щёлочь действует как катализатор, а также связывает образующиеся кислоты, превращая их в соли карбоновых кислот. Соли не способны вступать в реакцию этерификации с глицерином, и гидролиз становится необратимым. Неслучайно бытовые средства для удаления жира и засоров в раковинах более чем наполовину состоят из щёлочи.
Щелочной гидролиз жиров называют также омылением. Это название обусловлено тем, что образующиеся при этом натриевые и калиевые соли высших карбоновых кислот являются мылами.
Твёрдые жиры животного происхождения более ценны и дорогостоящи, чем жидкие растительные масла. Можно ли превратить жидкий жир в твёрдый химическим путём? Если вы вспомните, что растительные масла, в отличие от животных жиров, содержат остатки непредельных кислот, то нетрудно догадаться: гидрированием двойных связей С=С растительные масла превращают в аналог твёрдых жиров. Полученный продукт называют саломасом, его используют для приготовления маргарина и других продуктов питания:
Подобный процесс в больших масштабах проводят на жировых комбинатах.
Двойные связи непредельных кислот в жидких жирах сохраняют способность к реакциям полимеризации. Это свойство используют при изготовлении олифы — натуральной (на основе льняного или конопляного масла) или синтетической. При нанесении на деревянную поверхность олифа под действием кислорода воздуха полимеризуется с образованием прочной защитной плёнки. Олифу используют и при изготовлении и разбавлении масляных красок.
Справочная таблица «Сложные эфиры»
Конспект урока по химии «Сложные эфиры. Жиры». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие: