С чем взаимодействует оксид цинка
Цинк — общая характеристика элемента, химические свойства цинка и его соединений

Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
2Zn + O2 → 2ZnO.
При поджигании энергично реагирует с серой:
Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn + 2HCl → ZnCl2 + H2;
Zn + H2SO4 → ZnSO4 + H2.
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O;
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты:
Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH3 → Zn3N2 + 3H2;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO4 → Cu + ZnSO4;
Zn + CuO → Cu + ZnO.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl2 + H2O;
ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
Цинка Оксид
Химическое название
Химические свойства
Согласно фармакопее, Цинка Оксид или окись цинка – это кристаллический порошок без цвета, который не растворим в воде, этиловом спирте. Хорошо растворяется в разведенной минеральной кислоте и уксусной к-те. Под действием высокой температуры желтеет (из-за смещения края в спектре поглощения до синей области), сублимируется при 1800 градусах Цельсия. Молярная масса = 81,4 грамма на моль. Формула Оксида Цинка: ZnO. Обладает свойством поглощать углекислый газ из воздуха.
С чем реагирует вещество? По химическим свойствам – это амфотерное соединение, реагирует с кислотами, образуя соли, вступает в реакцию с кислотными и основными оксидами, а с растворами щелочей образует комплексные соединения. Оксид растворяется в р-ре аммиака в воде, при этом образуется комплексный аммиакат. Средство вступает в реакцию с оксидами металлов и щелочью, образуя цинкаты; с оксидом кремния и бора – силикаты и бораты. Оксид Цинка не реагирует с медью, кислородом, водой. Химическое соединение получают из природного минерала цинкита, при сжигании паров Zn в кислороде; при термическом разложении гидроксида, карбоната и нитрата Zn; с помощью гидротермального синтеза и оксилительного обжига сульфида.
Средство нашло широкое применение в фармацевтической и химической промышленности; при создании зубной пасты, цемента в стоматологии; вещество добавляют в состав косметики и кремов для загара; применяют в нефтеперерабатывающей, шинной и лакокрасочной промышленности; используют во время производства керамики и стекла, в электронике; добавляют в корм для животных; используют для преобразования ржавчины. Вещество слабо токсично. При вдыхании пыли с оксидом может развиться литейная лихорадка.
Фармакологическое действие
Антисептическое, подсушивающее, вяжущее, адсорбирующее.
Фармакодинамика и фармакокинетика
Вещество обладает способностью при нанесении на поверхность кожи и раневую поверхность денатурировать белки и образовывать альбуминаты. Средство значительно уменьшает выраженность процесса экксудации, снимает воспаление и раздражение. Образует барьерную пленку на коже, которая защищает ее от действия неблагоприятных факторов, обладает абсорбирующим эффектом.
Лекарство используют в виде присыпок, паст и мазей, линимента.
Показания к применению
Применение окиси цинка:
Противопоказания
Окись Цинка нельзя использовать на наличии аллергии на активный компонент.
Побочные действия
Редко возникают зуд, аллергические высыпания на коже, гиперемия.
Инструкция по применению (Способ и дозировка)
Цинка Оксид используют местно, наружно. В зависимости от лекарственной формы и болезни применяют разные схемы лечения.
Передозировка
Нет сведений о передозировке. Возможно развитие аллергических реакций.
Взаимодействие
Окись Цинка несовместима с ихтаммолом в составе мази.
Особые указания
Препараты на основе Цинка Оксида следует применять в соответствии с рекомендациями врача.
Нельзя допускать попадания лекарства в глаза.
Детям
Средство можно использовать при лечении пациентов всех возрастных категорий.
При беременности и лактации
Вещество разрешено к использованию во время беременности и при лактации.
Препараты, в которых содержится (Аналоги)
Отзывы
Отзывы о применении вещества оставляют в основном девушки, желающие избавится от акне. Лечебный эффект наступает достаточно быстро, средство хорошо переносится, при соблюдении рекомендаций по применению не пересушивает кожу. На форумах также активно обсуждается вред Оксида Цинка в косметике. Следует отметить, что данное вещество вреда коже не приносит, а напротив, улучшает ее состояние, обладает антиоксидантным действием, защищает от воздействия неблагоприятных факторов. Поэтому при грамотном применении средства, оно редко вызывает аллергические или другие побочные реакции.
Цена Оксида Цинка, где купить
Купить Оксид Цинка в аптеке можно в виде Цинковой Мази, стоимостью 30 рублей за 50 граммовый флакон. Приблизительная цена на мазь Деситин, 40% составляет 230 рублей за 57 тубу.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Оксид цинка
| Оксид цинка | |
|---|---|
 | |
 | |
| Систематическое наименование | Цинка оксид |
| Хим. формула | ZnO |
| Состояние | твёрдое |
| Молярная масса | 81,408 г/моль |
| Плотность | 5,61 г/см³ |
| Температура | |
| • плавления | 3587 ± 1 °F |
| • сублимации | 1800 °C |
| Мол. теплоёмк. | 40,28 Дж/(моль·К) |
| Энтальпия | |
| • образования | -350,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Показатель преломления | 2,015 и 2,068 |
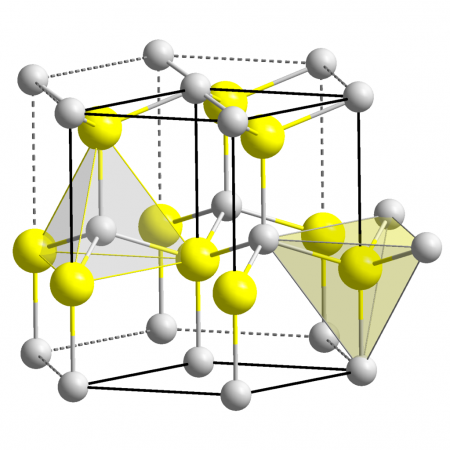
| Кристаллическая структура | гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 |
| ГОСТ | ГОСТ 10262-73 |
| Рег. номер CAS | 1314-13-2 |
| PubChem | 14806 |
| Рег. номер EINECS | 215-222-5 |
| SMILES | |
| RTECS | ZH4810000 |
| ChEBI | ZH4810000 |
| ChemSpider | 14122 |
| Предельная концентрация | аэрозоль в воздухе рабочей зоны 0,5 мг/м 3 в атмосферном воздухе 0,05 мг/м 3 |
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку |
| Фразы риска (R) | R50/53 |
| Фразы безопасности (S) | S60, S61 |
| Краткие характер. опасности (H) | H410 |
| Меры предостор. (P) | P273 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид цинка (окись цинка) ZnO — бесцветный кристаллический порошок, нерастворимый в воде, желтеющий при нагревании и сублимирующийся при 1800 °C.
Содержание
Свойства
Физические свойства
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное смещение стехиометрического отношения в сторону обогащения кислородом придаёт ему электронный тип проводимости.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю область видимого спектра.
Химические свойства
Химически оксид цинка амфотерен — реагирует с кислотами с образованием соответствующих солей цинка, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (например, Na2[Zn(OH)4], Ba2[Zn(OH)6] и др.):
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
При сплавлении со щелочами и оксидами некоторых металлов оксид цинка образует цинкаты:
При сплавлении с оксидом бора и диоксидом кремния оксид цинка образует стеклообразные бораты и силикаты:
При смешивании порошка оксида цинка с концентрированным раствором хлорида цинка образуется быстро (за 2—3 минуты) твердеющая масса — цинковый цемент.
Нахождение в природе
Известен природный минерал цинкит, состоящий в основном из оксида цинка.
Получение
Применение
Оксид цинка широко применяют в химической, фармацевтической промышленности. Применяется в составе зубных паст и цементов в терапевтической стоматологии, в косметических кремах для загара и косметических процедурах, в производстве в качестве наполнителя резины, искусственной кожи и резинотехнических изделий. Применяется в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка применяют при производстве стекла и керамики.
В химической промышленности
Известно также, что оксид цинка обладает фотокаталитической активностью, что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется.
В электронике
Оксид цинка применяется для производства варисторов, которые используются в современных ограничителях перенапряжений (ОПН) взамен морально устаревших газонаполненных разрядников.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров. На основе оксида цинка создан светодиод голубого цвета.
Тонкие плёнки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры.
Также оксид цинка входит в состав теплопроводных паст, например, пасты КПТ-8.
В медицине
В медицине используется в качестве компонента лекарственных средств наружного применения, используемых в дерматологии. Обладает противовоспалительным, подсушивающим, адсорбирующим, вяжущим и антисептическим действием.
Применяют в виде присыпки, мази, пасты, линимента. Является одним из компонентов ряда комплексных дерматологических и косметических препаратов, таких как «Цинковая мазь», «Паста Лассара» и пр.
Фармакологическое действие обусловлено тем, что оксид цинка образует альбуминаты и денатурирует белки. При нанесении на поражённую поверхность уменьшает явления экссудации, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов.
Может применяться при дерматите, в том числе пелёночном, опрелостях, потнице, поверхностных ранах и ожогах (солнечные ожоги, порезы, царапины), язвенных поражениях кожи (трофических язвах), пролежнях, экземе в стадии обострения, простом герпесе, стрептодермии.
Безопасность и токсичность
Соединение малотоксично, но его пыль вредна для органов дыхания, ПДК в воздухе рабочих помещений — 0,5 мг/м³ (по ГОСТ 10262-73). Пыль соединения может образовываться при термической обработке изделий из латуни.
Цинк. Химия цинка и его соединений
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
3s 

Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Нахождение в природе
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Химические свойства
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn 0 + H2 + O → Zn +2 O + H2 0
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
Zn + CuO → Cu + ZnO
Еще пример : цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Химические свойства
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr