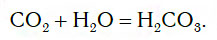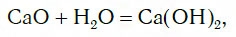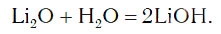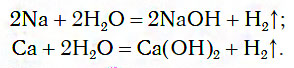С чем взаимодействует вода в химии
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
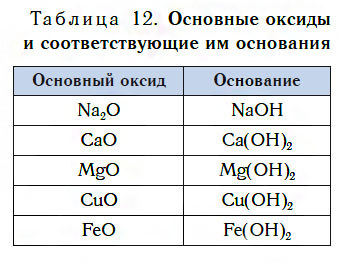
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
SiO2 + H2O → реакция не идет.
Урок №31. Физические и химические свойства воды. Применение воды
ВОДА
Молекула воды состоит из атома кислорода и двух атомов водорода, присоединившихся к нему под углом 104,5°.
Угол 104,5° между связями в молекуле воды обусловливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры. Именно поэтому крупные водоемы не промерзают до дна, что делает возможным существование в них жизни.
Физические свойства
ВОДА, ЛЁД И ПАР, соответственно жидкое, твердое и газообразное состояния химического соединения с молекулярной формулой Н 2 О.
Вода обладает исключительно большой теплоёмкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.
Химические свойства воды
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочноземельными металлами. Вода образует соединения – кристаллогидраты.
Под действием электрического тока вода разлагается на водород и кислород:
2H 2 O электрический ток = 2H 2 ↑+ O 2 ↑
I. Взаимодействие воды с металлами
Щелочные металлы – это I(А) группа – Li, Na, K, Rb, Cs, Fr
Щелочноземельные металлы – это II(А) – Ca, Sr, Ba, Ra (Be, Mg не относятся)
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Например, бериллий с водой образует амфотерный оксид: Be + H 2 O = BeO + H 2
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие воды c неметаллами
Cl 2 + H 2 O = HCl + HClO
C + H 2 O = t°С = CO + H 2
Si + 2H 2 O = t°С = SiO 2 + 2H 2
III. Взаимодействие с оксидами металлов
1). Взаимодействие с основными оксидами
Реакция соединения протекает при обычных условиях, при этом образуется растворимое основание – щёлочь.
H 2 O + ОКСИД МЕТАЛЛА = Ме(ОН) n (р. соединения)
Na 2 O + H 2 O = 2NaOH
BaO + H 2 O = Ba(OH) 2
Al 2 O 3 + H 2 O ≠ нет реакции
I. Реакции, в которых вода играет роль окислителя
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н + 2О = 2NaOH + H 0 2↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2) Взаимодействие с неметаллами, имеющими низкую ЭО
(реакции происходят в жестких условиях)
C + Н + 2О = CO + H 0 2↑ («водяной газ»)
В присутствии щелочей кремний вытесняет водород из воды:
3) Взаимодействие с гидридами металлов
NaH + Н + 2 O = NaOH + H 0 2↑
4) Взаимодействие с угарным газом и метаном
Реакции используются в промышленности для получения водорода.
II. Реакции, в которых вода играет роль восстановителя
1) Взаимодействие с фтором
2) Взаимодействие с атомарным кислородом
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
Реакции гидратации
I. Гидратация ионов.
Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 • 5H2O, FeSO4• 7Н2O и др., а также аквакомплексов: [Cr(H2O)6]CI3, [Pt(H2O)4]Br4 и др.
II. Гидратация оксидов
III. Гидратация органических соединений, содержащих кратные связи
Реакции гидролиза
Fe 3+ + Н2O = FeOH 2+ + Н + ; (кислая среда. рН
в) по катиону и по аниону соли
II. Гидролиз карбидов металлов
III. Гидролиз силицидов, нитридов, фосфидов
IV. Гидролиз галогенов
V. Гидролиз органических соединений
Классы органических веществ
Продукты гидролиза (органические)
Альдегиды или кетоны
Галогенангидриды карбоновых кислот
Ангидриды карбоновых кислот
Сложные зфиры карбоновых кислот
Карбоновые кислоты и спирты
Глицерин и высшие карбоновые кислоты
Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза)
С чем взаимодействует вода в химии
Ключевые слова конспекта: вода, физические и химические свойства воды, водные растворы.
Физические свойства воды
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха, плотность 1 кг/л, температура кипения 100 °С при 1 атм, температура плавления 0°С. У воды высокая удельная теплоемкость — 4,12 кДж/кг К), поэтому она долго нагревается и медленно остывает. У воды большая теплота испарения. На испарение 1 г воды требуется 2,25 кДж теплоты.
Атомы Н и О в молекуле воды соединены полярными ковалентными связями. На атоме водорода в молекуле Н2О имеется небольшой положительный заряд δ+, а на атоме кислорода — небольшой отрицательный δ-. Поскольку молекула воды имеет уголковое строение, она представляет собой двухполюсную частицу — диполь: 
Химические свойства воды
Вода реагирует со многими металлами по типу реакций замещения.
С наиболее активными металлами — от Li по Аl в ряду активности металлов при комнатной температуре протекают реакции замещения одного атома Н в молекуле Н2O. С магнием реакция идет при нагревании, с алюминием — после снятия защитной оксидной пленки. В реакции образуются гидроксиды металлов — соединения, содержащие гидроксогруппу ОН, и водород:
2Li + 2Н2O = 2LiOH + Н2↑,
Са + 2Н2O = Са(ОН)2 + Н2↑.
Менее активные металлы — Zn, Mo, W, Fe — взаимодействуют с водой при высокой температуре (400-600 °С). В этих реакциях образуются оксиды металлов и водород:
Zn + Н2O = ZnO + Н2↑,
3Fe + 4Н2O = Fe3O4 + 4Н2↑
Вода реагирует с оксидами активных металлов (реакция гидратации). При этом получаются растворимые в воде гидроксиды металлов — щелочи:
Na2O + Н2O = 2NaOH,
СаО + Н2O = Са(ОН)2.
Вода соединяется с оксидами многих неметаллов. При этом получаются растворимые в воде гидроксиды неметаллов — кислоты:
СO2 + Н2O = Н2СO3,
SO3 + Н2O = H2SO4.
Гидролиз — это обратимая реакция обмена, например соли с водой. При этом происходит расщепление молекул воды на Н и ОН, которые входят в состав двух новых веществ:
К2СO3 + Н2O = КНСО3 + КОН,
РСl3 + ЗН2O = Н3РО3 + ЗНСl.
Вода в жизнедеятельности человека. Водные растворы
Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды. Все процессы в живой клетке осуществляются в водной среде. В сутки человеку необходимо 2 л питьевой воды. Кроме того, вода нужна, чтобы варить пищу, стирать белье, умываться. Большие количества пресной воды расходуются в промышленности и сельском хозяйстве (растворитель). Отметим, что соленая вода морей и океанов для этих целей непригодна. Доля пресной воды в общих запасах воды на Земле составляет менее 3% от всех водных ресурсов.
Вода — химический реагент. Соединяясь с оксидами активных металлов, вода образует щелочи, а в реакциях с оксидами неметаллов дает кислоты — два больших и важных в деятельности человека класса веществ. Один из способов синтеза этилового спирта (этанола) C2H5OH — реакция этилена С2Н4 с водой:
Временная или карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Са(НСО3)2, магния Mg(HCO3)2 и железа Fe(HCO3)2. При кипячении воды гидрокарбонаты разлагаются с образованием осадка карбоната, и жесткость воды снижается:
Са(НСO3)2 = СаСО3↓ + СO2↓ + Н2O,
Fe(HCO3)2 = FeCO3↓ + CO2↓ + Н2O.
Другой способ устранения временной жесткости — действие известкового молока или соды:
Постоянная жесткость воды обусловлена присутствием в ней хлоридов, сульфатов и других растворимых солей кальция, магния и железа. Ее устраняют действием соды:
СаСl2 + Na2CO3 = СаСO3↓ + 2NaCl.
Водный раствор — разновидность раствора, в котором растворителем служит вода. Будучи превосходным растворителем, именно вода используется для приготовления большинства растворов в химии.
Вещества, которые плохо растворяются в воде, называют гидрофобными (‘боящимися воды’), а хорошо в ней растворяющиеся — гидрофильными (‘любящими воду’). Примером типичного гидрофильного соединения может служить хлорид натрия (поваренная соль).
Если вещество образует водный раствор, который хорошо проводит электрический ток, то он называется сильным электролитом; в противном случае — слабым.
Конспект урока по химии «Вода. Свойства воды. Водные растворы». Выберите дальнейшее действие: