С помощью чего образована первичная структура белка
Строение и функции белков. Денатурация белка
Перед тем, как начать разбираться со строением белка и его функциями нужно кое-что прояснить. А что вообще такое белок? Как организм создает такое многообразие белков, если имеет ограниченный запас аминокислот?
Белок — это полимерная молекула, которая состоит из молекул поменьше — мономеров. Мономеры для белка — аминокислоты, которые соединяются между собой пептидными связями. Но здесь появляется вопрос, а сколько аминокислот нужно соединить между собой для того, чтобы получить белок? Больше 50. Если их будет меньше, то такая молекула называется пептид.
Все аминокислоты соединяются друг с другом в определенной последовательности, которая уникальна для каждого белка. Кто это контролирует? ДНК — ведь она и кодирует все эти аминокислоты. Ну а теперь можем начинать разбираться со структурой.
Первичная структура белка
Представляем себе огромную цепь, которая состоит из кучи звеньев. Такой же вид у первичной структуры белка — это просто полипептидная цепь, которая включает в себя аминокислоты. Их всего 20 штук. Но представьте себе сколько комбинаций можно сделать с этими 20 аминокислотами, соединяя их в разных последовательностях? Правильно, бесконечное множество.
Теперь посмотрим на молекулу поближе. Можно увидеть, что у этой большой молекулы есть свободная аминогруппа — N-конец, и свободная карбоксильная группа — C-конец. Молекулу всегда рисуют с N-конца и заканчивают C-концом.
Все остальные аминокислоты связаны друг с другом пептидной связью. Сумма всех пептидных связей — это пептидный остов. В него не входят радикалы, N-концы и C-концы. Будет понятнее, если я нарисую всё в одну линию.
В первичной структуре есть только пептидные связи
Важный момент! Первичная структура определяет какими будет вторичная, третичная и четвертичная (если такая есть) структуры. Это как мини-ДНК для белковой молекулы. Но я об этом еще напомню, даже несколько раз, вот такая я зануда.
Вторичная структура белка
Ну что, а теперь давайте усложнять все! Что можно сделать с цепью, которую мы рассмотрели до этого? Может закрутим цепь вокруг чего-то? Или просто растянем ее вдаль? Можно даже растянуть цепь и повернуть ее обратно, чтобы начало и конец были в одном месте. Что вам больше нравится?
Какой бы вариант не выбрали — он верный, но все зависит от того, какой тип вторичной структуры будет у белка. Напоминаю, что это определяется первичной :]
1. Альфа-спираль
Это для ребят, которые выбрали закрутить цепь вокруг чего-то. Правда закручивается она вокруг самой себя. В этой цепи происходит образование водородной связи между кислородом (карбоксильного атома углерода) и водородом (связан с азотом).
Далековато как-то. Как так выходит? Все из-за того, что происходит закручивание пептидного остова. Сделаем такую же картинку как сверху, но в виде атомов. Не забудем крутануть её немного…
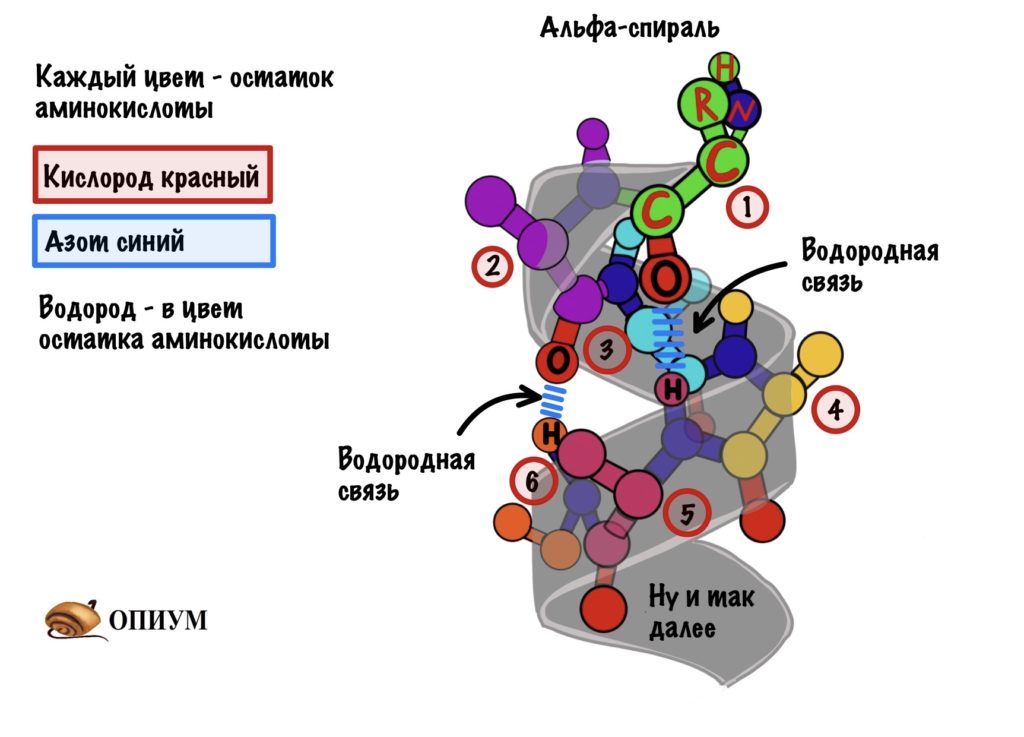
Каждый цвет — это остаток аминокислоты, только азоты и кислороды я оставил одного цвета, а то запутаемся ещё. Ещё альфа-углерод тут трех валентный и все атомы отмечать не стал, а то слишком громоздко получается. Думаю, что смысл понятен.
Какой сделаем вывод? Альфа-спираль похожа на корсет. Правда вместо него — водородные связи, которые стягивают её. Если присмотреться к радикалам, то они выглядывают как иголки из ёлки в разные стороны. Вот рисунок попроще.
Ой, а вы, наверное, ждали какой то супер крутой рисунок? А я тут такое подсунул, ладно держите вот немного получше. Правда он без радикалов и водородных связей. Но здесь лучше видно, что на один виток спирали приходится 3,6 аминокислотных остатка.
Альфа-спираль, конечно, очень красивый вариант, но он не всегда образуется. Есть аминокислоты, которые могут помешать этому:
Пролин. В его молекуле находится жесткое кольцо, которое всегда вызывает поворот. Такая уж у него структура. Если вставить его в альфа спираль, то произойдет поворот на 180 градусов. Ещё у пролина нет свободного водорода у азота. Получается, что он не может образовывать водородную связь, которая так важна для альфа-спирали.
Глицин. Если пролин слишком жесткий, то глицин, наоборот, очень гибкий. У него ведь нет радикала, поэтому если вставить слишком много глицинов, то прощай альфа-спираль. Иногда из-за него тоже происходит поворот молекулы на 180 градусов — прямо как на картинке выше.
Аминокислоты с большими радикалами. Большие радикалы круто, но если они будут расположены рядом, то это может помешать формированию альфа-спирали. Они просто мешают друг другу.
И последнее, одинаково заряженные аминокислоты. При одинаковом заряде они отталкиваются допустим: рядом расположены лизин и аргинин, или аспартат и глутамат. Ну и другие комбинации.
Если в полипептидной цепи много включений с такими радикалами, то чаще всего образуется…
2. Бета-складчатый слой
Здесь молекула будет похожа на лист, который состоит из нескольких тяжей. А они похожи на горки из игры Gravity defied. Хотя кому я это говорю….
Ладно, давайте просто посмотрим на рисунок, а лучше на два — один сбоку, а другой сверху. Что видим? Один тяж с горками, которые идут то вверх, то вниз. Радикалы аминокислот расположены над или под плоскостью листа.
Теперь можно составить из тяжей бета-складчатый слой. Здесь, как всегда, несколько вариантов. Первый вариант — параллельный лист, тогда направление тяжей одинаковое. Если оно разное, то он антипараллельный. Стабилизируется этот лист тоже с помощью водородных связей, прямо как альфа-спираль. Только вот есть один нюанс. Если в альфа-спирали есть четкая зависимость образования связей — через 4 аминокислотных остатка, то здесь такого нет. Например, водородными связями могут соединяться 5 остаток и 22.
Когда мы разбирали альфа-спираль, то сказали что пролин и иногда глицин вызывают поворот на 180 градусов. У этого есть свое название: бета-поворот.
3. Беспорядочный клубок
Это последний вариант. Здесь нет никаких спиралей или бета-складчатости, просто получается вот такая белиберда.
Что общего у всех вторичных структур? В их образовании участвует только пептидный остов. Радикалы пока что отдыхают. Ну и второе:
Водородные связи стабилизируют вторичную структуру
Ой, а от чего зависит какую вторичную структуру примет молекула?
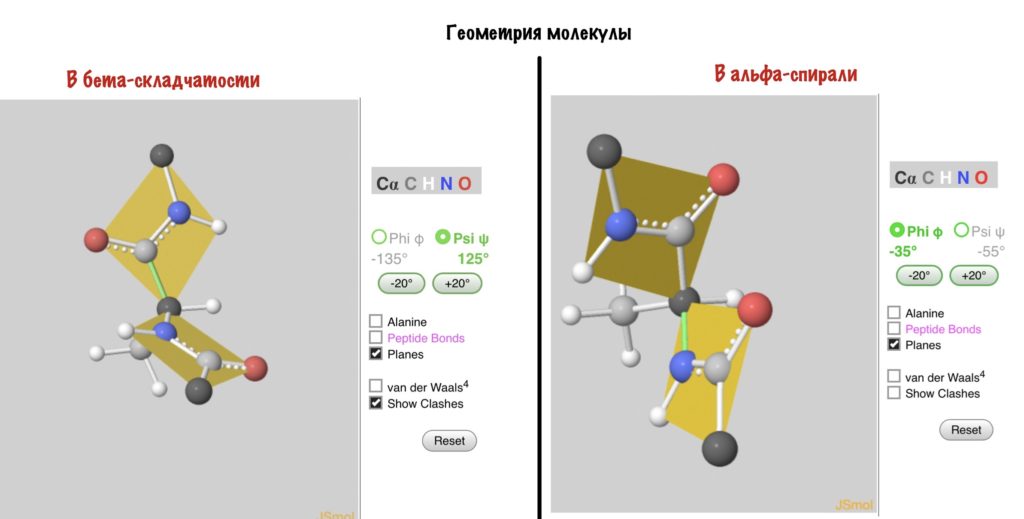
А действительно, почему какая-то молекула принимает форму альфа-спирали, а другая бета-складчатости? Хороший вопрос, и у меня есть ответ на него: от торсионных углов. Я разбирал это в прошлой статье — кликай сюда, а потом возвращайся. Так, мы говорили о том, что углы бывают разными, но для каждой вторичной структуры характерны строго определенные углы. Есть специальные карты Рамачандрана, на которых указаны эти углы — все данные получены экспериментально.
Здесь можно посмотреть как будут выглядеть молекулы аминокислот с такими углами. Но вот вам фоточка, если лень.
Надеюсь, что теперь понятно почему и как формируется вторичная структура. Ах да, конечно же, все эти углы определяются первичной структурой!
Супервторичная
структура белка
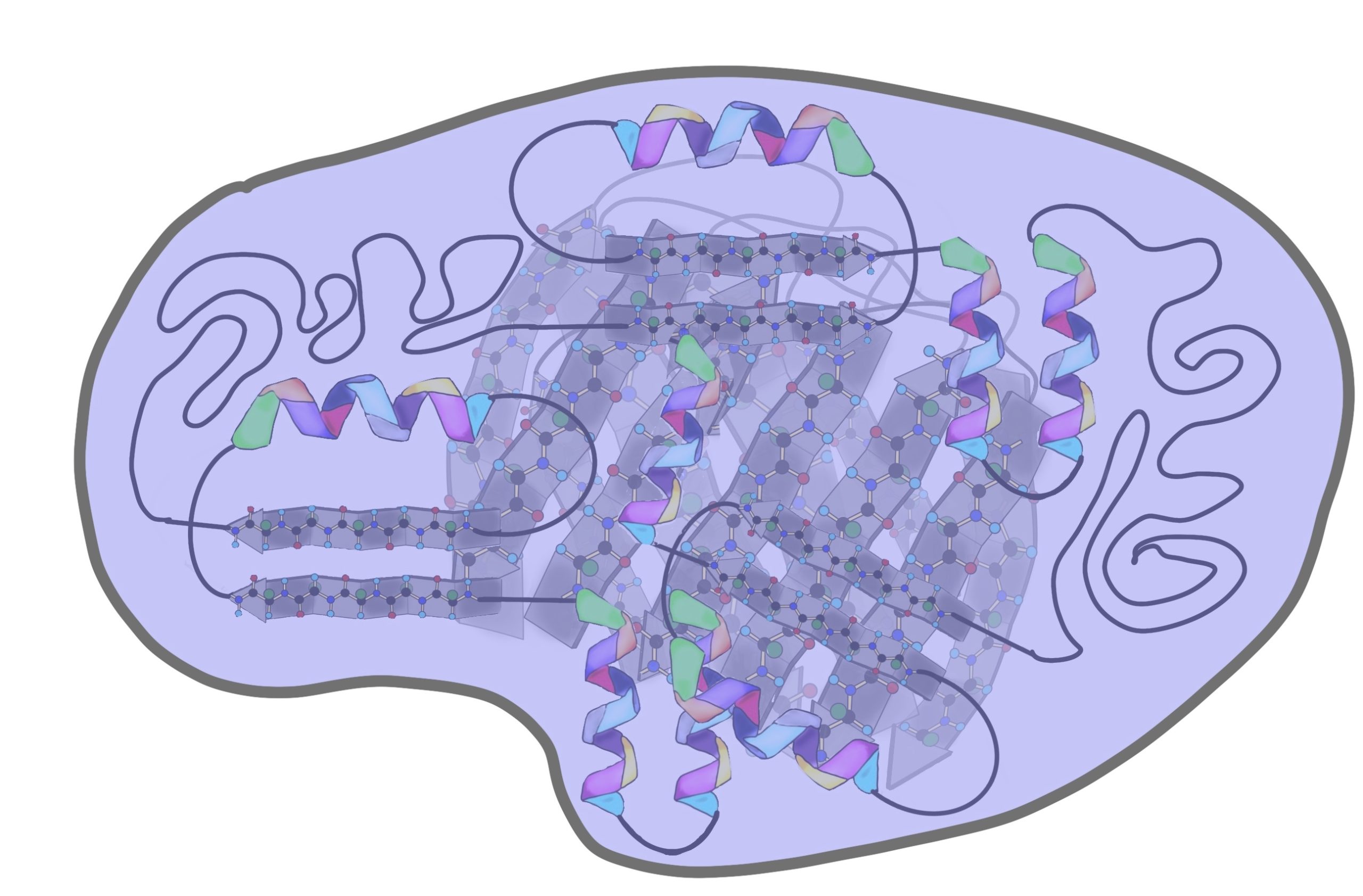
До этого мы разбирали вторичные структуры изолированно, но представьте себе очень длинную полипептидную цепь. Не может же она вся закручиваться в альфа-спираль или становиться бета-складчатой. Хотя иногда и может, но об этом позднее. Чаще всего белок — это комбинация из альфа-спиралей, бета-тяжей и беспорядочных клубков. То есть может это выглядеть примерно вот-так.
Поймите, что супервторичная структура белка не стоит выше, чем вторичная. Это просто название, которое неправильно отражает суть, поэтому оно мне не нравится. На западе используют другое название — структурные мотивы, оно намного лучше. Вот в чем его суть: хоть у нас огромное количество самых разных белков, но в них есть определенные повторяющиеся паттерны — это и есть мотивы. Наиболее частые из них: бета-тяж + альфа-спираль + бета-тяж (бета-альфа-бета петля); альфа-спираль + бета-поворот + альфа-спираль; бета-бочонок.
Мотивов очень много, но думаю смысл понятен. Простые мотивы могут объединяться и образовывать мотивы посложнее.
Я использовал в иллюстрациях прошлые картинки, но помните, что эти альфа-спирали и бета-тяжи отличаются друг от друга аминокислотными остатками — они очень разные! Просто перерисовывать все это не хочется.
Третичная структура белка
Вот этот уровень уже повыше, на нем белок начинает выполнять свою функцию — впахивать, как проклятый. Но сначала нужно остановиться ненадолго и поговорить. Спокойно, я же сказал — ненадолго.
Согласитесь, что у белков очень много функций. Какой-то переносит кислород, а другой входит в состав кости и обеспечивает ее прочность. Белки мышечной ткани вообще обеспечивают движение. Давайте попробуем выделить две глобальные, но не совсем верные, функции: структурная и связывания. Одни белки входят в структуру мышц, костей, волос и так далее. А другие что-то связывают: ферменты связываются с субстратом, а гемоглобин с кислородом. А где-то бравое антитело падает на амбразуру для того, чтобы не пропустить бактерию в организм. Это конечно все очень грубо, но пусть будет так.
И все это я к чему. Существует два больших класса белков: фибриллярные — коллаген, эластин, кератин. Эти ребята занимаются поддержкой, такие вот суппорты. Фибрилла — это нить. Так что они очень длинные, а когда огромное количество нитей связывается в одну, то они становятся очень прочными. Фибриллярные белки — это атланты, которые держат наш организм на своих плечах. А мы не особо благодарные ребята, потому что забьем на них. Но только в этой статье.
В основном биохимия занимается другим классом — глобулярными белками. Эти ребята не только связывают — у них огромное количество функций. С этими функциями и пытается разобраться биохимия. Глобула — шар. Вроде это все, теперь можем приступать.
На прошлом этапе мы собрали разные вторичные структуры в мотивы, ну а дальше то что? Теперь нам нужно скрутить все это в компактный шарик — глобулу. Здесь, наконец-то, пригодятся наши лентяи — радикалы. Вспоминаем, что радикалы бывают полярные и неполярные. Когда глобула скручивается, то она прячет гидрофобные остатки аминокислот внутрь этого шарика, а гидрофильные выставляет наружу. Оно и понятно, все-таки глобулы находятся в организме, а у нас почти везде вода.
Скручивание — удивительный процесс. Здесь начинают взаимодействовать очень (очень-очень!) отдаленные аминокислотные остатки. Представьте, что тридцатый остаток взаимодействует с триста семидесятым. При этом все настолько предопределено первичной структурой, что радикалы взаимодействуют максимально точно. А взаимодействий ведь не мало!
Кстати о них, какими они бывают:
Про все эти связи у меня есть статейка ;] Ещё раз сказу, что здесь взаимодействуют только радикалы.
Когда глобула сложилась в пространстве, то всю эту сложную структуру называют конформацией (получается, что конформация — это положение атомов друг относительно друга в пространстве). Есть еще кое-что интересное: посмотрите на связи, которые образуют эту структуру. Большая часть из них — это силы слабого взаимодействия между молекулами. Это значит, что они очень легко рвутся, даже простого повышения температуры на несколько градусов хватит для того, чтобы эти связи разорвались. Как выйти из такого положения такой большой молекуле? Дело в том, что таких связей настолько много, что существует конформационная лабильность. По сути это означает, что некоторые связи могут рваться, а другие тут же образовываться.
Какой можно сделать вывод из всего этого? Не стоит думать о третичной структуре белка, как о чем-то статичном. Представьте ее как дом, который меняет свой цвет при повышении или понижении температуры, еще он может менять свой размер в зависимости от того идет дождь или нет. Какой странный дом…. В таком долго не проживешь.
Некоторые участки глобулы такие чсвшники, что собираются отдельно от всей остальной молекулы. Эти части называются доменами. Домен собирается в мини-третичную структуру самостоятельно, их даже может быть несколько. Чаще всего они имеют какую-то важную задачу, например, входят в состав активного центра.
Строение активного центра
Стоп-стоп-стоп. Это тиво еще такое? Ты про это ничего не говорил. Точно, помните мы сказали, что с этого уровня белок начинает пахать? А задача глобулы — это связать что-то, опять же грубо. Так вот, как она все это делает? Да-да, через активный центр, такие вы умные конечно… В чем прикол активного центра? Он должен соответствовать молекуле, с которой будет взаимодействовать. Это называется комплементарностью. Не путать с комплиментами.
Активный центр — это замок, а другая молекула — ключ, которые должны подходить друг другу. Такие вот соулмейты. Хотя к некоторым активным центрам могут подходить много ключиков. Связи, которые образуются в активном центре — слабые: чаще всего ионные, водородные и Ван-дер-Вальсовы. Но иногда могут быть и ковалентными, но не будем забегать вперёд — об этом мы поговорим, когда будем разбирать ферменты.
Ну а теперь, как все это работает. В активном центре располагается уникальная последовательность аминокислот, допустим там будет две положительнозаряженных и две отрицательнозаряженных аминокислоты. А у молекулы, с которой происходит взаимодействие, будет: две отрицательных группы и две положительных. Форма молекулы совпадает с формой активного центра. Кстати, у молекулы, которая взаимодействует с активным центром тоже есть свое название — лиганд. Надоели уже эти названия? Мне тоже…
Ах, да — вся третичная структура определяется первичной…. Я знаю, что вы запомнили, но хочу немного понадоедать.
5 типов связей стабилизируют третичную структуру: водородные, гидрофобные, Ван-дер-Вальсовы, ионные и дисульфидные. Эти связи образуются между радикалами.
Четвертичная структура белка
Последняя, но самая большая! Не пугайтесь, только по размеру. Она есть не у всех белков, некоторые прекрасно работают в виде третичной структуры и не парятся. Но представьте, что мы возьмем несколько третичных структур и как соединим их вместе. Пусть их будет 4 штуки, берем 4 шарика и соединяем их. Получаем четвертичную, но не из-за того, что мы взяли 4 шарика….
Эти шарики комплементарны друг другу в участках связывания — не активный центр, но чем-то похоже. Таких участков связывания много, поэтому ошибиться и не узнать своего товарища очень трудно.
Каждая глобула, которую мы взяли — это отдельная полипептидная цепь. Прочитай это еще раз. До этого все касалось только одной полипептидной цепи, а теперь их несколько. Такая цепь называется мономером (или субъединицей), а при соединении мономеров образуется олигомер. Так что вся большая молекула — это олигомер.
Какие связи все это стабилизируют? Чаще всего это водородные, ионные и Ван-дер-Вальсовы, так как каждый мономер прячет свои гидрофобные остатки вглубь молекулы, то они образуются редко. Получается, что четвертичную структуру стабилизируют силы слабого взаимодействия, ковалентных связей здесь почти никогда не бывает — очень редко могут быть дисульфидные. Поэтому можем спокойно забить на них.
В чем отличие четвертичной структуры от третичной? Ну кроме того, что тут объединено несколько полипептидных цепей. А вот какое — у олигомерных белков есть не только активный центр, но и другой — аллостерический центр. К этому замку не подойдут лиганды от активного центра, у него есть свои собственные ключики. Это очень важно, нужно запомнить! Господи, я превращаюсь в препода….
Проведем аналогию с нашим домиком, только теперь их будет несколько. У каждого будет по главному и черному входу! Главный вход — активный центр, а черный ход — это аллостерический центр.
Аллострические центры дают кое-что важное — регуляцию. Маленькая молекула, которая соединится с аллостерическим центром может остановить работу целого огромного белка. Круто? Получается, что размер не важен — не удержался.
Но каким образом одна молекула останавливает работу целого белка? Очень просто — хотел бы я так сказать. Присоединение молекулы к мономеру изменяет его конформацию. А это ведет к тому, что мономер изменяет конформацию других мономеров — происходят конформационные изменения всей структуры белка. В результате этих изменений закрывается активный центр — лиганд не может к нему подойти. У всех этих изменений есть, как и всегда, свое название — кооперативный эффект.
И опять я про дом, если открыть черный ход, то нельзя открыть главный вход, ну и наоборот. Не всегда регуляция работает в таком ключе: черный ход может, наоборот, открывать парадную дверь. Но сейчас это не суть, главное понять смысол. Кстати, на самом деле чаще одна субъединица несет на себе аллостерический центр, а другая активный. Я решил запихнуть все в одну — думаю, что так будет нагляднее.
Кроме этого, присоединение к активному центру также изменяет конформацию остальных мономеров, что приводит к облегченному присоединению лигандов. Хоть на картинке этого и не видно, но поверьте на слово!
В четвертичной структуре взаимодействуют несколько полипептидных цепей!
Стабилизируется молекула силами слабого взаимодействия.
Давайте заканчивать уже со строением.
Простые и сложные белки
До этого мы говорили, что белок — это полипептидная цепь, которая что-то там делает. Иногда даже несколько цепей соединяются и образуют олигомер. Но мы кое-что упускали все это время. Ведь не все белки состоят только из полипептидных цепей. У гемоглобина есть гем, а это не белковая часть, ого! Белки, которые располагаются на поверхности мембран соединяются с углеводами, которые спасают их от разрушения.
Получается, что у некоторых белков есть дополнительные компоненты. Есть простые белки — они состоят только из аминокислотных остатков, а есть белки сложные. Они включают в себя белковую часть (апопротеин), и небелковую (простетическая группа). Простетические группа связана с белком с помощью ковалентных связей — просто так её не оторвёшь. Она очень важна, потому что белки без неё уже не могут работать. Простетических групп очень много — это могут быть металлы, углеводы, гем, липиды и еще куча всего. Но это так, для общего развития.
У нас осталось последнее.
Денатурация белка
Так долго мы добирались до четвертичной структуры, но теперь время все УНИЧТОЖИТЬ. Денатурация — это потеря функции белка, через разрушение его четвертичной, третичной и вторичной структуры. Но не первичной! Процесс может остановиться и раньше, не дойдя до первичной. Но самое важное — белок перестает работать. Это значит вот что: если у белка есть только третичная структура, то её потеря приведёт к потере функций. Тоже самое касается белков с четвертичной структурой.
Денатурирующие факторы делятся на физические и химические.
Физические факторы
У всех этих факторов общий механизм действия. Они вносят в систему дополнительное количество энергии. Это вызывает увеличение амплитуды колебательных движений фрагментов полипептидной цепи. Из-за этого рвутся слабые связи, стабилизирующие белковую молекулу — водородные, гидрофобные и Ван-дер-Вальсовы. Вот некоторые из этих факторов:
Химические факторы
Химические денатурирующие факторы различаются по механизму действия. Так что разбираемся с каждым отдельно. Представим, что мы рвём каждую связь:
1) Добавим кислоту или щелочь в раствор, где находится белок — произойдет изменение заряда некоторых аминокислот. Раз изменился заряд, то происходит разрушение водородных и ионных связей.
2) Детергенты — это вещества, у которых есть гидрофобные и гидрофильные участки. Если засунуть их внутрь молекулы, то гидрофобное взаимодействие нарушится. Примеры детергентов — фенолы, додецилсульфат.
3) С помощью тяжелых металлов мы порвем дисульфидные мостики в третичной структуре. Такими тяжелыми металлами будут: свинец, медь и ртуть.
4) Восстанавливающие агенты — восстанавливают дисульфидные связи. Смысл такой же, как и с тяжелыми металлами: разрушение дисульфидных мостиков. Пример — меркаптоэтанол.
5) Вещества, образующие водородные связи — мочевина. Это ужасная воровка, она перетягивает водородные связи с белка на себя.
Но, мы сказали, что это разрушает вторичную, третичную и четвертичную структуры, но не первичную. Она остается целой. А так как она отвечает за формирование всех остальных, то при удалении денатурирующего фактора белок может снова стать работоспособным, восстановив свою структуру. Это процесс называется ренативация белка. Для этого нужны определённые условия, но они не всегда достижимы в клетке. Поэтому для большинства белков денатурация — это необратимый процесс.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Структура белков: первичная, вторичная, третичная
Первичная структура белка и её свойства
В настоящее время расшифрована первичная структура около 2500 белков, а в природе имеется 1012 разнообразных белков.
Первичная структура – это последовательность (порядок) соединения аминокислотных остатков с помощью пептидной связи.
Пептидная связь образуется за счет карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты.
В образовании первичной структуры участвуют α-аминокислоты.
Пептидная связь образует остов полипептидной цепи, она является повторяющимся фрагментом.
Свойства первичной структуры белка
1. Детерминированность – последовательность аминокислот в белке генетически закодирована. Информация о последовательности аминокислот содержится в ДНК.
2. Уникальность – для каждого белка в организме характерна определенная последовательность аминокислот.
Аминокислоты, входящие в состав белков делят на 2 группы:
В белковой молекуле различают 2 вида замен аминокислот:
Консервативная – замена одной аминокислоты на другую сходную по структуре. Такая замена не приводит к изменению свойств белка.
Примеры: гли-ала, асп-глу, тир-фен, вал-лей.
Радикальная замена – замена одной аминокислоты на другую отличающуюся по структуре. Такая замена приводит к изменению свойств белка.
Примеры: глу-вал, сер-цис, про-три, фен-асп, илей-мет.
При радикальной замене возникает белок с другими свойствами, что может привести к патологии.
3. Универсальность первичной структуры. Белки, выполняющие одинаковые функции в разных организмах имеют одинаковую или близкую первичную структуру.
В природных белках одна и та же аминокислота не встречается подряд больше 3 раз.
Белки – полимеры, мономерами кот. являются аминокислоты, связанные пептидной связью.

За начало цепи принимается ее N-конец.
Основная связь первичной структуры белков – пептидная. Особенности строения пептидной связи: 1. Кислород и водород находятся в транс-положении по отношению к оси – С – N –. 2. Основным состоянием пептидной цепи является промежуточное состояние м/д двумя крайними, когда на О небольшой «-», а на N – небольшой «+» заряд.
Т.е. пептидная связь (0,132 нм) является промежуточной м/д одинарной (0,146 нм) и двойной (0,127 нм). При такой структуре пептидная связь является плоской и вращение С — N в пептидной связи невозможно. Однако в каждом аминокислотном звене есть α-углеродный атом, который обусловливает присутствие в этом звене двух одинарных связей; вокруг этих связей возможно вращение. Углы вращения одинарных связей называются торсионными и обозначаются через φ (N — Сα) и ψ(С — Сα).
Число возможных комбинаций торсионных углов велико, и многие из них реализуются в белках.
Вторичная структура белка как упорядоченное пространственное расположение отдельных участков полипептидной цепи без учёта типа и конформации боковых радикалов аминокислот. Образуется за счёт замыкания водородных связей между пептидными группами. Разделение на упорядоченные и аморфные области. Ансамбли сверхвторичной структуры и домены.
Вторичная структура — это упорядоченное пространственное расположение отдельных участков полипептидной цепи без учета типа и конформации боковых радикалов аминокислот.
Она образуется за счет замыкания водородных связей между пептидными группами. Вторичная структура представлена в основном такими регулярными структурами как α-спираль, складчатые слои (β-структура), β-изгиб.
Часть полипептидной цепи не имеет упорядоченного строения, такие участки называют аморфными или бесструктурными областями.
α-спирали — торсионные углы близки к —60, —45°, все водородные связи примерно параллельны оси спирали и коллинеарны друг другу, что отвечает минимуму свободной энергии; каждая карбонильная группа образует водородную связь с четвертой по ходу цепи NH-группой, замыкается максимально возможное число водородных связей, что придает прочность этой структуре.
Параметры: число аминокислотных остатков на виток спирали — 3,6; число атомов в витке, замыкаемом водородной связью, — 13; диаметр спирали —0,5 им; шаг спирали —0,54 нм, проекция остатка на ось – 0,15 нм.
В природных белках обнаружены только правые α-спирали.
Боковые радикалы аминокислот в α-спирали обращены наружу и расположены по разные стороны от ее оси. Неполярные боковые радикалы аминокислот обычно группируются на одной стороне α-спирали, образуя неполярные дуги; это создает условия для сближения разных спиральных участков.
Складчатые структуры – торсионные углы φ и ψ близки к —120, + 135°. Тоже являются спиральными, но здесь эта спираль сильно вытянута.
Параметры: число остатков на «виток» равно 2 (в плоском складчатом слое) или 2,3 (в слегка скрученном слое), проекция остатка на ось — 0,33 нм, радиус «спирали» — 0,1 нм.
Складчатые участки полипептидной цепи проявляют кооперативные свойства, т. е. стремятся расположиться рядом в белковой молекуле, и формируют параллельные и антипараллельные β-складчатые слои/листы, которые укрепляются благодаря водородным связям между складчатыми участками цепи.
Антипараллельная структура образуется, в том случае, если складчатая цепь делает поворот назад и идет вдоль самой себя, т.
е. в обратном направлении; в месте поворота образуется β-изгиб. В β-изгиб входят четыре последовательно расположенных аминокислотных остатка. Антипараллельность цепей создает наиболее благоприятные условия для возникновения водородных связей между ними при участии пептидных групп. Водородные связи располагаются под углами к цепям.
Параллельная β-структура складывается участками из полипептидной цепи, направления которых совпадают.
В случае параллельного расположения цепей в структуре складчатого β-слоя водородные связи между цепями менее прочны, расположены перпендикулярно к цепям.
Боковые радикалы аминокислотных остатков (связи Сα — Сβ) приблизительно перпендикулярны плоскости β-складчатых слоев, причем боковые цепи аминокислот ориентированы поочередно то по одну, то по другую сторону этой плоскости.
На некоторых участках белковой цепи встречается нерегулярная укладка аминокислотных остатков в пространстве, которая также удерживается благодаря водородным связям и гидрофобным взаимодействиям.
Такие области в белковой молекуле называются неупорядоченными, бесструктурными или аморфными.
α-спиральные и β-структурные участки в белках могут взаимодействовать друг с другом и между собой, образуя ансамбли.
Пространственное строение таких ансамблей вторичной структуры называют сверхвторичной структурой белковой молекулы.
Суперспирализованная α-спираль – две α-спирали скручены друг относительно друга, образуя левую суперспираль.
Сверхспираль могут образовывать α-спирали, расположенные как параллельно, так и антипараллельно. Встречаются в глобулярных белках (бактериородопсин, гемэритрин), а чаще и в наиболее упорядоченной форме — в фибриллярных белках. Суперспирализация выгодна энергетически, так как между боковыми радикалами аминокислот, принадлежащих разным α-спиралям, образуются дополнительные нековалентные контакты (ван-дер-ваальсовые).

Домены – структурно и функционально обособленные области (субобласти) молекулы, соединенные друг с другом короткими участками полипептидной цепи, которые называются шарнирными участками.
Функциональные домены могут состоять из одного или нескольких структурных доменов. Структурные домены содержаться в ферментах (фермент состоит из 2х полипептидных цепей, к каждой цепи 3 структурных домена). Домены выполняют определенную функцию при действии фермента. М/д доменами в углублении располагается активный центр.
Фибриллярность и глобулярность. Обеспечение третичной структуры за счёт водородных, ионных, ванн-дер-ваальсовых, ковалентных (дисульфидных) связей и гидрофобных взаимодействий, формируемых боковыми радикалами аминокислот.
Третичная структура –пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации (пространственная укладка всей молекулы белка, если она образована одной полипептидной цепью).
По форме, кот. характеризуется показателем «степень асимметрии» (отношение длинной оси молекулы к короткой): нитевидные/фибриллярные – белки, имеющие степень асимметрии 80 и выше (фиброин шелка, кератин волос, рогов, копыт, коллаген соединительной ткани); глобулярные – белки со степенью асимметрии менее 80 белки, большинство из них имеет степень асимметрии 3—5, третичная структура их характеризуется достаточно плотной упаковкой полипептидной цепи в виде клубкообразной молекулы, приближающейся по форме к шару.
В поддержании третичной структуры глобулярных белков, ее закреплении принимают участие различные типы связей: ковалентные, ионные/солевые, водородные и гидрофобные взаимодействия (указаны в порядке убывания энергии связи).
Преимущественную роль в формировании третичной структуры отводят гидрофобным взаимодействиям, возникающим между неполярными боковыми радикалами аминокислот.

К замыканию ковалентных дисульфидных связей (—S—S—) приводит окисление сульфгидрильных (тиольных) групп в присутствии кислорода или некоторых других реагентов, либо эти связи образуются самопроизвольно, если тиольные группы в результате пространственной укладки полипептидной цепи оказываются расположенными рядом, т.
е. дисульфидные связи стабилизируют конформацию молекулы, но не определяют характер свертывания полипептидной цепи. Часто встречаются в секретируемых белках (змеиные яды, пептидные гормоны, пищеварительные ферменты, белки молока и др.).
Наличием большого числа дисульфидных мостиков в фибриллярных белках (например, кератине), способных к взаимному превращению с сульфгидрильными группами, т. е. к временному разрыву и образованию заново, отчасти объясняются свойства вязкости и эластичности этих белков. Дисульфидные мостики никогда не образуются между соседними остатками цистеина.
Солевые/ионные связи возникают между группами белков, имеющими противоположные заряды, т.
е. между боковыми радикалами аминокислот, диссоциированными по кислотному и основному типам. Группы, способные к ионизации, и полярные группы аминокислот обычно находятся на поверхности белковой глобулы и реже встречаются внутри. Заряженные группы на поверхности белковой глобулы обычно сольватированы и окружены противоионами, что увеличивает растворимость белков в водной среде. Полярные боковые радикалы аминокислот, находящиеся внутри белковой молекулы, обычно образует водородные связи между собой или с полипептидным остовам.
Нахождение заряженных групп внутри глобулы энергетически невыгодно, поэтому они там встречаются редко.
Если все-таки заряженные группы локализуются внутри глобулы, то они образуют солевые мостики.
Гидрофобное взаимодействиеимеет преимущественную роль в формировании III структуры.
Возникает м/д неполярными и полярными боковыми радикалами аминокислот. Боковые радикалы, не имеющие сродства к воде, оказываются компактно упакованными, в основном, внутри глобулы, образуя гидрофобные области, стабилизирующие третичную структуру молекулы. Гидрофобные области (ядра) в центре белковой глобулы имеют высокую плотность упаковки, характерную для многих кристаллов, что свидетельствует об эффективном использовании нековалентных сил при организации пространственной структуры белковой молекулы.
Небольшая часть неполярных радикалов может находиться на поверхности молекулы, и, скапливаясь, образовывать гидрофобные кластеры. Таким образом, в целом поверхность белковой глобулы мозаична; в основном гидрофильна, но содержит и небольшие неполярные участки.
Наиболее слабые связи между молекулами обусловлены дисперсионными силами ван-дер-ваальсова притяжения (иногда их называют ван-дер-ваальсовыми связями).
Они возникают только на достаточно малом расстоянии между молекулами и имеют в основе кулоновские силы электростатического притяжения. Ядра внутри электронных оболочек атомов находятся в постоянном колебательном движении, поэтому возможно временное смещение электронных орбит относительно ядра, что ведет к образованию диполя.
Последние существуют короткое время, но оно достаточно для возникновения согласованной ориентации между молекулами.
Водородные связи возникают между двумя электроотрицательными атомами, когда протон водорода, ковалентно связанный с одним из этих атомов, располагается между ними.
Электроотрицательными (т. е. обладающими повышенной способностью притягивать электроны) являются атомы О, N, F, реже в образовании водородных связей участвуют С1 и S.
Атом водорода содержит единственный электрон, и когда последний уходит на образование ковалентной связи, ядро остается без электронных слоев. Такой водород, т. е.
протон, не отталкивается, естественно, электронными облаками соседних атомов, а наоборот, притягивается ими, образуя водородную связь.
Обязательное условие образования водородной связи — наличие у электроотрицательного атома хотя бы одной свободной пары электронов, к которым будет притягиваться атом водорода. Электроотрицательные атомы обладают повышенным сродством к электронам, поэтому они заполняют электронами весь внешний слой (8 электронов), как бы перегружаясь отрицательными зарядами.
При этом если возникает пара свободных электронов, она взаимодействует с протоном.
Структурная организация белков
Доказано существование 4 уровней структурной организации белковой молекулы.
Первичная структура белка – последовательность расположения аминокислотных остатков в полипептидной цепи. В белках отдельные аминокислоты связаны друг с другом пептидными связями, возникающими при взаимодействии a-карбоксильных и a-аминогрупп аминокислот.
К настоящему времени расшифрована первичная структура десятков тысяч разных белков.
Для определения первичной структуры белка методами гидролиза выясняют аминокислотный состав. Затем определяют химическую природу концевых аминокислот. Следующий этап — определение последовательности аминокислот в полипептидной цепи. Для этого используют избирательный частичный (химический и ферментативный) гидролиз. Возможно применение рентгеноструктурного анализа, а также данных о комплементарной нуклеотидной последовательности ДНК.
Вторичная структура белка – конфигурация полипептидной цепи, т.е. способ упаковки полипептидной цепи в определенную конформацию. Процесс этот протекает не хаотично, а в соответствии с программой, заложенной в первичной структуре.
Стабильность вторичной структуры обеспечивается в основном водородными связями, однако определенный вклад вносят ковалентные связи – пептидные и дисульфидные.
Наиболее вероятным типом строения глобулярных белков считают a-спираль.
Закручивание полипептидной цепи происходит по часовой стрелке. Для каждого белка характерна определенная степень спирализации. Если цепи гемоглобина спирализованы на 75%, то пепсина-всего на 30%.
Тип конфигурации полипептидных цепей, обнаруженных в белках волос, шелка, мышц, получил название b-структуры. Сегменты пептидной цепи располагаются в один слой, образуя фигуру, подобную листу, сложенному в гармошку.
Слой может быть образован двумя или большим количеством пептидных цепей.
 а а |  б б |
| Рис. |
1. Вторичная структура белка: а — a-спираль, б — b-структура.
В природе существуют белки, строение которых не соответствует ни β-, ни a-структуре, например, коллаген — фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных.
Третичная структура белка – пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
Первый белок, третичная структура которого была выяснена рентгеноструктурным анализом — миоглобин кашалота (рис. 2).
В стабилизации пространственной структуры белков, помимо ковалентных связей, основную роль играют нековалентные связи (водородные, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, гидрофобные взаимодействия и т.д.).
По современным представлениям, третичная структура белка после завершения его синтеза формируется самопроизвольно.
Основной движущей силой является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот погружаются внутрь белковой молекулы, а полярные радикалы ориентируются в сторону воды.
Процесс формирование нативной пространственной структуры полипептидной цепи называют фолдингом. Из клеток выделены белки, названные шаперонами. Они участвуют в фолдинге. Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций процесса фолдинга (пигментозы, фиброзы и др.).
Методами рентгеноструктурного анализа доказано существование уровней структурной организации белковой молекулы, промежуточных между вторичной и третичной структурами.
Домен — это компактная глобулярная структурная единица внутри полипептидной цепи (рис. 3). Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.
 |  |
| Рис. |
2. Третичная структурамиоглобина
Все биологические свойства белков связаны с сохранностью их третичной структуры, которую называют нативной.
Белковая глобула не является абсолютно жесткой структурой: возможны обратимые перемещения частей пептидной цепи. Эти изменения не нарушают общей конформации молекулы. На конформацию молекулы белка оказывают влияние рН среды, ионная сила раствора, взаимодействие с другими веществами. Любые воздействия, приводящие к нарушению нативной конформации молекулы, сопровождаются частичной или полной потерей белком его биологических свойств.
Четвертичная структура белка — способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой или разной первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
Белковую молекулу, состоящую из нескольких полипептидных цепей, называют олигомером, а каждую входящую в него цепь — протомером.
Олигомерные белки чаще построены из четного числа протомеров, например, молекула гемоглобина состоит из двух a- и двух b-полипептидных цепей (рис. 4).
Четвертичной структурой обладает около 5% белков, в том числе гемоглобин, иммуноглобулины. Субъединичное строение свойственно многим ферментам.
 |
| Рис. |
4. Молекула гемоглобина
Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. Биологическую активность белок приобретает только при объединении входящих в его состав протомеров.
В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной.
Некоторые исследователи признают существование пятого уровня структурной организации белков.
Это метаболоны —полифункциональные макромолекулярные комплексы разных ферментов, катализирующих весь путь превращений субстрата (синтетазы высших жирных кислот, пируватдегидрогеназный комплекс, дыхательная цепь).
Структура белков
Каждому белку свойственна своя особая геометрическая форма, или конформация. При описании трехмерной структуры белков рассматривают обычно четыре разных уровня организации, которые мы здесь и опишем.
Первичная структура
Под первичной структурой белка понимают число и последовательность аминокислот, соединенных друг с другом пептидными связями в полипептидной цепи (рис. 5.31). Первые исследования по выяснению аминокислотной последовательности белков были выполнены в Кембриджском университете Ф. Сэнгером, дважды удостоенным за свои работы Нобелевской премии.
Сэнгер работал с гормоном инсулином (рис. 5.32), и это был первый белок, для которого удалось выяснить аминокислотную последовательность. Работа заняла ровно 10 лет (1944-1954 гг.). В молекулу инсулина входит 51 аминокислота, а молекулярная масса этого белка равна 5733. Молекула состоит из двух полипептидных цепей, удерживаемых вместе дисульфидными мостиками.

Рис. 5.31. Часть полипептидной цепи, представленная с целью показать первичную структуру. А1 А2, А3 и А4 — различные аминокислоты

Рис. 5.32. Первичная структура (аминокислотная последовательность) инсулина. Молекула состоит из двух полипептидных цепей, удерживаемых вместе двумя дисульфидными мостиками
В настоящее время большая часть работ по определению аминокислотных последовательностей автоматизирована, и теперь первичная структура известна уже для нескольких сотен белков.
На рис. 5.33 изображена первичная структура фермента лизоцима.

Рис. 5.33. Первичная структура лизоцима. Лизоцим — это фермент, обнаруженный во многих тканях и секретах человеческого тела, в растениях и яичном белке.
Этот фермент катализирует разрушение клеточных стенок бактерий. Молекула лизоцима состоит из одной пол и пептидной цепи, в которую входит 129 аминокислотных остатков. В молекуле имеется четыре внутрицепочечных дисульфидных мостика
В организме человека свыше 10000 различных белков, и все они построены из одних и тех же 20 стандартных аминокислот.
Аминокислотная последовательность белка определяет его биологическую функцию. В свою очередь эта аминокислотная последовательность однозначно определяется нуклеотидной последовательностью ДНК (разд.
22.6). Замена одной — единственной аминокислоты в молекулах данного белка может резко изменить его функцию, как это наблюдается, например, при так называемой серповидноклеточной анемии (разд. 23.9). Интересные данные могут быть получены в результате анализа аминокислотных последовательностей гомологичных белков, принадлежащих разным биологическим видам; такие данные позволяют судить о возможном таксономическом родстве между этими видами.
а) Напишите аминокислотные последовательности всех трипептидов, которые можно построить из двух разных аминокислот А и В.
б) Исходя из того, что у вас при этом получилось, составьте формулу для определения числа различных трипептидов, которые могут быть построены из двух разных аминокислот.
в) Сколько полипептидов длиной в 100 аминокислотных остатков можно построить из двух разных аминокислот?
г) Сколько полипептидов длиной в 100 аминокислотных остатков (а это сравнительно небольшой белок) можно построить из всех 20 стандартных аминокислот?
д) Сколько пептидов или полипептидов (заданной длины) можно построить из всех 20 стандартных аминокислот?
Вторичная структура
Для всякого белка характерна помимо первичной еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину. Это так называемая α-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами.
Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка (считая вдоль цепи назад) (рис. 5.34). Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.

Рис. 5.34. Структура α-спирали. А. Показаны α-атомы углерода. Соединяющая их линия описывает α-спираль. Б. Модель α-спирали из стержней и шариков. В. Часть α-спирали в растянутом виде. Спираль стабилизируется водородными связями
Полностью α-спиральную конформацию и, следовательно, фибриллярную структуру имеет белок кератин. Это структурный белок волос, шерсти, ногтей, когтей, клюва, перьев и рогов, входящий также в состав кожи позвоночных.
Твердость и растяжимость кератина варьируют в зависимости от числа дисульфидных мостиков между соседними полипептидными цепями (от степени сшивки цепей).
Теоретически все СО- и NH-группы могут участвовать в образовании водородных связей, так что α-спираль — это очень устойчивая, а потому и весьма распространенная конформация.
Тем не менее большинство белков существует в глобулярной форме, в которой имеются также участки β-слоя и участки с нерегулярной структурой. Объясняется это тем, что образованию водородных связей препятствуют наличие некоторых аминокислотных остатков в полипептидной цепи, наличие дисульфидных мостиков между различными участками одной и той же цепи и, наконец, тот факт, что аминокислота пролин вообще неспособна образовывать водородные связи.
β-Слой, или складчатый слой, — это другой тип вторичной структуры. Белок шелка фиброин, выделяемый шелкоотделительными железами гусениц шелкопряда при завивке коконов, представлен целиком именно этой формой. Фиброин состоит из ряда полипептидных цепей, вытянутых сильнее, чем цепи с конформацией α-спирали. Эти цепи уложены параллельно, но соседние цепи по своему направлению противоположны одна другой (антипараллельны).
Они соединены друг с другом при помощи водородных связей, возникающих между С=0- и NH-группами одной цепи и NH- и С=0-группами соседних цепей.
В этом случае в образовании водородных связей также принимают участие все NH- и С=О-группы, т. е. структура тоже весьма стабильна. Такая конформация полипептидных цепей называется (β-конформацией, а структура в целом — складчатым слоем (рис. 5.35). Фиброин обладает высокой прочностью на разрыв и не поддается растяжению, но подобная организация полипептидных цепей делает шелк очень гибким. В глобулярных белках полипептидная цепь может складываться на себя, и тогда в этих точках глобулы возникают участки, имеющие структуру складчатого слоя.

Рис. 5.35. Складчатый слой. Полипептидные цепи удерживаются рядом друг с другом при помощи водородных связей, образующихся между NH- и СО-группами. R-группы аминокислот располагаются над и под плоскостью этого складчатого слоя.
А. Две антипараллельные полипептидные цепи.
Б. Структура из трех полипептидных цепей изображена здесь так, чтобы показать складки между R-группами
Еще один способ организации полипептидных цепей мы находим у фибриллярного белка коллагена. Здесь три полипептидные цепи свиты вместе, образуя тройную спираль. В каждой полипептидной цепи этой сложной спирали, называемой тропоколлагеном (рис.
5.36), содержится около 1000 аминокислотных остатков. Такой белок тоже невозможно растянуть, и это его свойство существенно для той функции, которую он выполняет, например, в сухожилиях, костной и других видах соединительной ткани.
Белки, существующие только в полностью спирализованной форме, подобно кератину или коллагену, представляют собой исключение среди прочих белков.

Рис. 5.36. Трехспиральная структура коллагена
Третичная структура
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу.
Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается уже обсуждавшимися выше связями трех типов — ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями (рис. 5.37).