серонегативна по тохо что это
TORCH-инфекции
Описание
Развёрнутый комплекс лабораторных маркёров, позволяющий оценить наличие иммунитета к потенциально опасным для плода TORCH-инфекциям, выявить острую инфекцию.
Подготовка
Содержание
В данный профиль входят следующие анализы:
Важно!
TORCH-инфекции (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes) считаются потенциально опасными для развития ребёнка. В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2-3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Anti-Toxo-IgG (Антитела класса IgG к Тoxoplasma gondii)
Антитела класса G к Токсоплазме гондии (Т. gondii).
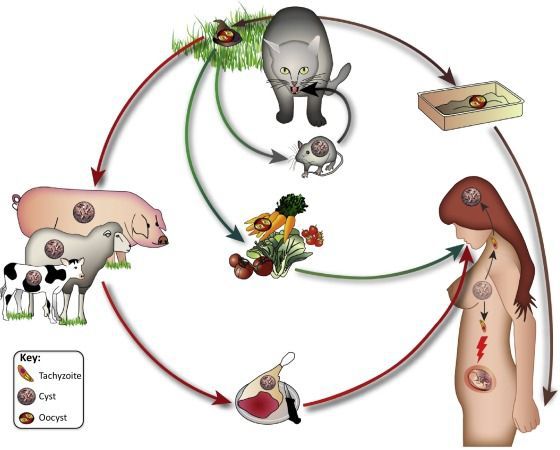
Особенности инфекции. Возбудитель — Toxoplasma gondii — относится к простейшим. Жизненный цикл возбудителя проходит внутри клеток организма-хозяина. Окончательный хозяин паразита — заражённые кошки и прочие представители семейства кошачьих выделяют с испражнениями особую форму токсоплазм — ооцисты. Ооцисты устойчивы во внешней среде. Попавшие в организм промежуточного хозяина (грызуны, птицы, скот, человек) ооцисты продолжают жизненный цикл, в мышечной и других тканях организма, где образуются псевдо- и истинные цисты.
Anti-Toxo-IgM (Антитела класса IgM к Тoxoplasma gondii)
Антитела класса М к Toxoplasma gondii.
Анти-Toxo-IgM появляются в течение 2 недель после инфицирования и могут сохраняться до года и более. Их присутствие не является, таким образом, строгим показателем острой инфекции. Но обнаружение у ранее серонегативных (то есть не имевших антител к Toxoplasma gondii) женщин при беременности анти-Toxo-IgM антител указывает на свежую инфекцию, которая может приводить к врождённому токсоплазмозу.
Особенности инфекции. Возбудитель токсоплазмоза — токсоплазма (Toxoplasma gondii) — относится к простейшим. Жизненный цикл возбудителя проходит внутри клеток организма-хозяина. Окончательный хозяин паразита — заражённые кошки и прочие представители семейства кошачьих выделяют с испражнениями особую форму токсоплазм — ооциты. Ооцисты устойчивы во внешней среде. Попавшие в организм промежуточного хозяина (грызуны, птицы, скот, человек) ооцисты продолжают жизненный цикл, в мышечной и других тканях организма, где образуются псевдо- и истинные цисты.
Anti-CMV-IgG (Антитела класса IgG к цитомегаловирусу, ЦМВ)
Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ).
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВИ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ) указывают на текущую или имевшую место в прошлом цитомегаловирусную инфекцию.
Anti-CMV-IgM (Антитела класса IgM к цитомегаловирусу, ЦМВ)
Антитела класса IgM к цитомегаловирусу (CMV, ЦМВ).
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Специфические антитела отвечают за лизис внутриклеточного вируса, а также ингибируют его внутриклеточную репликацию или распространение от клетки к клетке. Сыворотки пациентов после первичной инфекции содержат антитела, реагирующие с внутренними протеинами ЦМВ (р28, р65, р150). В сыворотке выздоровевших людей содержатся в основном антитела, реагирующие с гликопротеинами оболочки.
Наибольшее диагностическое значение имеет определение IgM, как показателя активности процесса, что может свидетельствовать об остро текущем заболевании, реинфекции, суперинфекции или реактивации. Появление анти-CMV IgM антител у ранее серонегативного пациента свидетельствует о первичной инфекции. При эндогенной реактивации инфекции IgM-антитела образуются нерегулярно (обычно в довольно низких концентрациях) или могут вообще отсутствовать. Выявление иммуноглобулинов класса G также позволяет определить первичную цитомегаловирусную инфекцию (ЦМВИ), проводить наблюдение в динамике за лицами с клиническими проявлениями инфекции и помогать при ретроспективной диагностике. При тяжелой ЦМВИ, а также у беременных и детей раннего возраста выработка антител к ЦМВ замедлена. Это проявляется обнаружением специфических антител в низкой концентрации или отсутствием положительной динамики антител.
Anti-Rubella-IgG (Антитела класса IgG к вирусу краснухи)
Индикатор наличия иммунитета к вирусу краснухи.
Anti-Rubella-IgM (Антитела класса IgM к вирусу краснухи)
Антитела класса IgМ к вирусу краснухи.
Anti-HSV-IgG (Антитела класса IgG к вирусу простого герпеса 1 и 2 типов)
Антитела класса G к вирусу простого герпеса 1 и 2 типов (ВПГ, HSV), свидетельствующие о предшествующей или текущей инфекции вирусом простого герпеса 1 или 2 типов.
Антитела класса G вырабатываются в период хронической инфекции вирусом простого герпеса первого или второго типа.
Anti-HSV-IgМ (Антитела класса IgМ к вирусу простого герпеса 1 и 2 типов)
Антитела класса М к вирусу простого герпеса 1 и 2 типов (ВПГ, HSV). Маркёр первичного инфицирования вирусом простого герпеса.
Серонегативна по тохо что это
Внедрение новых лабораторных технологий, таких как иммуноферментный анализ (ИФА), реакция прямой и непрямой иммунофлюоресценции (РИФ), полимеразной цепной реакции (ПЦР), создали принципиально новую возможность для диагностики, контроля лечения и прогнозирования инфекций, а также позволили внедрить масштабное серологическое тестирование отдельных групп населения на различные инфекции. Появление в последние годы на мировом рынке тест-систем с новой направленностью позволяют не только подтвердить диагноз врожденного или приобретенного токсоплазмоза, но и оперативно (в течение 2-3-х дней) определить активность инфекционного процесса, что на фоне роста иммунодефицитных состояний и внутриутробных имеет важное значение для выбора тактики ведения пациента и принятия адекватных мер.
ЭТИОЛОГИЯ
Возбудитель был впервые описан в 1909 году Nicolle et Manceaux при обнаружении его у североафриканских грызунов. В 1914 году на территории Шри-Ланки был впервые описан случай заболевания у человека. Жизненный цикл токсоплазм был расшифрован лишь в 1970 году.
ЭПИДЕМИОЛОГИЯ
Токсоплазмозная инвазия имеет широкое, практически повсеместное распространение: на земном шаре от 500 млн до 1,5 млрд человек инфицировано токсоплазмами. Возбудитель встречается повсеместно. Пораженность населения в разных странах зависит от санитарно-гигиенических условий, особенностей питания населения, влияния экологических факторов, частоты иммунодефицитных состояний и др. В развивающихся странах высока инфицированность детского населения. Распространенность токсоплазмоза в России в возрасте от 20 до 40 лет составляет по различным данным от 8-10% до 23%. Жители сельской местности инфицируются гораздо чаще, чем городское население. В Омском регионе пораженность токсоплазмами составляет 10-14% среди городского населения и 32-45% среди сельского населения и нарастает с возрастом. До настоящего времени нет данных о соотношении инфицированных и заболевших как взрослых, так и детей.
Источником возбудителя инвазии являются домашняя кошка и многие виды диких и домашних животных. Для токсоплазмоза характерно наличие природных очагов. Заражение
людей происходит различными путями: 1) алиментарным путем (при употреблении в пищу недостаточно термически обработанного мяса или сырого мясного фарша, содержащих тканевые цисты токсоплазм, а также через грязные руки при контакте с кошками или употреблении овощей и ягод, загрязненных ооцистами); 2) контактным путем (контаминация возможна при повреждении кожных покровов и слизистых у ветеринарных врачей, работников боен, мясокомбинатов, продавцов мяса; возможно и внутрилабораторное заражение); 3) конгениталъным (трансплацентарным) путем (заражение плода токсоплазмами происходит гематогенным путем у 30-40% женщин, заразившихся в период данной беременности при наличии у них острого или инаппарантного токсоплазмоза; а также у беременных с ВИЧ-инфекцией и выраженным иммунодефицитом, у которых при наличии в организме цист токсоплазм в результате рецидива возможно появление трофозоитов в крови); 4) парентеральным путем (возможно заражение при переливании инфицированной крови и пересадке органов).
Токсоплазмоз играет значительную роль в патологии детей и взрослых. В последние годы токсоплазмоз все чаще регистрируется у больных с иммунодепрессией, особенно у больных со злокачественными новообразованиями и при пересадке органов, у которых при первичном инфицировании или обострении могут возникать тяжелые формы заболевания с летальным исходом. В организме с хорошей иммунорезистентностью он редко дает типичные манифестные формы: в 80-90% это заболевание протекает бессимптомно и остается недиагностированным ввиду отсутствия патогномоничных признаков. Факторы риска заражения и заболевания:
— традиционное употребление в пищу полусырых мясных продуктов;
— контакт с бесхозными и домашними кошками, свободно охотящимися за мышами и птицами;
кормление кошек сырыми мясными отходами и отсутствие туалета для кошек;
недостаточное соблюдение мер личной профилактики;
оказание ветеринарной помощи домашним животным (особенно кошкам);
— переливание инфицированной токсоплазмами крови или пересадка органов; вторичный иммунодефицит, особенно ВИЧ-инфекция, при которой существует высокий риск развития токсоплазменного энцефалита.
Возможно профессиональное заражение медицинского персонала, контактирующего с кровью и проводящего вагинальное обследование женщин.
Токсоплазмоз опасен для беременных женщин. Он вызывает прерывание беременности в ранние сроки, мертворождение, рождение детей с аномалиями развития и поражением ЦНС и других органов. Примерно 5-7% женщин впервые инфицируются в период беременности. При инфицировании женщин в течение всего периода беременности в среднем рождается 61% здоровых детей и 39% детей с врожденным токсоплазмозом. При первичной инфекции в период беременности в результате присутствия возбудителя в материнской, крови (продолжительное время и в достаточно высокой концентрации) возбудитель проникает через фетоплацентарный барьер, особенно в случае его нарушения.
КЛИНИКА
В зависимости от механизма инфицирования различают приобретенный и врожденный токсоплазмоз. Он может проявляться в легкой, средне-тяжелой и тяжелой
форме и иметь острое или хроническое течение. По классификации Сиима (Siim, 1971) с
учетом преобладающей органной патологии выделяют 5 клинических форм:
лимфонодулярную, генерализованную (экзантемную), миокардитическую,
энцефалитическую, глазную. В других классификациях также выделяют кишечную (абдоминальную) и легочную формы острого токсоплазмоза.
Приобретенный токсоплазмоз. Инкубационный период длится от 3 до 21 дня, но может удлиняться до нескольких месяцев. Длительность инкубационного периода зависит от вирулентности* токсоплазм, массивности инфицирования и состояния преморбидного фона (наличие врожденного или приобретенного иммунодефицита и степень его Выраженности).
Острый токсоплазмоз протекает в виде следующих форм.
Лимфонодулярная форма_- характеризуется поражением шейных, затылочных лимфатических узлов, реже мезентериальных и паратрахеальных, подмышечных, паховых.
Обычно увеличение лимфоузлов сопровождается лихорадкой, головной болью, болями в мышцах; возможна гепатоспленомегалия. Лимфаденопатия и субфебрилитет могут держаться длительно. В период обострения лимфатические узлы вновь могут увеличиваться.
Генерализованная (экзантемная) форма начинается остро с высокой температуры, ознобом, головной болью. Макулопапуллезная сыпь обычно появляется на 3-4-й день заболевания и исчезает постепенно через 2 нед. Уже с первых дней выявляются симптомы энтерита, увеличение печени и селезенки. Характерно увеличение лимфатических узлов, иногда возникает миокардит. Эти симптомы часто сочетаются с поражением ЦНС, которое может протекать по типу энцефалита или менингоэнцефалита. Наиболее тяжело заболевание протекает у детей и стариков и может закончиться летально (особенно у детей от 1 года до 3 лет).
Миокардитическая форма диагностируется при доминирующем в клинике заболевания поражении сердца. Клиническая картина токсоплазменного миокардита существенно не отличается от миокардитов другой этиологии и характеризуется умеренной температурой, слабостью, одышкой, сердцебиением, болью и неприятными ощущениями в области сердца.
Подострый токсоплазмоз характеризуется явлениями энцефаломиелита, арахноидита в сочетании с симптомами миокардита при снижении температуры, угасании симптомов поражения лимфатических узлов, кишечника, легких, уменьшении гепатоспленомегалии. Может наблюдаться поражение глаз.
Приобретенный токсоплазмоз нередко принимает хроническое течение, и частота таких случаев возрастает в связи с ростом в популяции лиц с иммуной недостаточностью. При этом выявляются симптомы длительной интоксикации: общая слабость, быстрая утомляемость, боли в мышцах, суставах, головная боль. Особенно характерны продолжительный субфебрилитет лимфаденопатия, явления мезаденита, болезненность при пальпации отдельных мышечных групп с возможным обнаружением уплотненных участков, увеличение размеров печени без существенного нарушения ее функций. Нередко поражаются сердце и нервная система. В последние годы возросла частота глазной формы, которая нередко протекает в форме микстинфекции в сочетании с поражением глаз герпетической или цитомегаловирусной природы и протекает в виде системного процесса.
При хроническом вялотекущем энцефалите отмечаются слабость, апатия, головная боль, боли в мышцах, нарушение сна, вегетососудистая дистония, астено-невротический, гипертензионно-гидроцефальный или судорожный синдром, полирадикулоневриты, нейро-эндокринные нарушения.
При исследовании крови у большинства больных отмечаются эозинофилия и моноцитоз.
Конечный результат перинатальных инфекций определяют ряд факторов:
1) срок беременности;
2) тип возбудителя и его вирулентность;
3) восприимчивость матери и плода к инфекции, во многом определяемая генетическим особенностями;
4) тип материнской инфекции (первичная или вторичная);
5) состояние иммунной системы матери в момент инфицирования; наиболее тяжелые последствия наблюдаются у женщин с иммунодефицитными состояниями (первичными или вторичными, и особенно комбинированными);
6) наличие специфического антительного иммунитета у матери, а также уровень материнских антител, перешедших плоду трансплацентарно;
7) длительность контакта возбудителя с плодом;
8) степень созревания и поражения плаценты;
9) сочетанность инфицирования (вирусными, бактериальными, паразитарными инфекциями; вирусы обладают наибольшей проникающей активностью, что усугубляет течение патологического процесса).
Выделяют три клинические формы врожденного токсоплазмоза, которые являются последовательными стадиями развития инфекционного процесса: острая генерализованная форма (с гепатоспленомегалией и желтухой), подострая (с явлениями энцефалита), хроническая (с явлениями постэнцефалического дефекта).
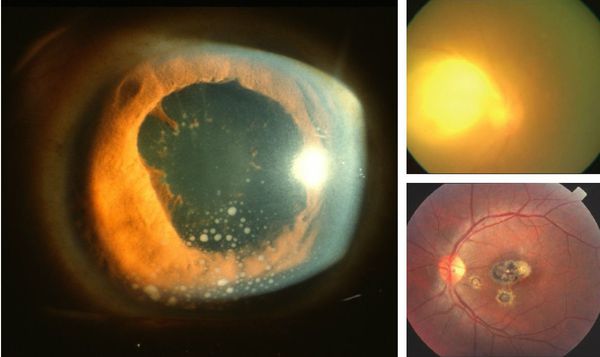
В тех случаях, когда стадии генерализации и энцефалита прошли внутриутробно, ребенок рождается с хронической формой токсоплазмоза при наличии грубых повреждений ЦНС (картина постэнцефалитического состояния) и глаз (от хориоретинита до микрофтальмии). Наиболее характерной патологией на глазном дне является псевдоколобома желтого пятна в результате перенесенного воспалительного процесса. Характерна триада симптомов: гидроцефалия, внутримозговые кальцификаты и хориоретинит. Возможна микроцефалия с внутренней гидроцефалией.
При заражении в III триместре у новорожденных чаще преобладают асимптомные формы. Однако если инфицирование произошло незадолго до рождения ребенка, то внутриутробно начавшаяся стадия генерализации продолжается и после рождения и проявляется разнообразными клиническими симптомами.
Острая’форма врожденного токсоплазмоза выявляется чаще всего у недоношенных детей, протекает очень тяжело по типу сепсиса. Летальность зараженных новорожденных колеблется от 1 до 6%. Выжившие дети страдают задержкой умственного развития или другими проявлениями нарушений ЦНС. Характерная для врожденного токсоплазмоза триада (гидроцефалия, хориоретинит и внутричерепные кальцификаты) встречается редко.
При остром токсоплазмозе состояние ребенка с первых дней болезни тяжелое. Выражены симптомы интоксикации. Довольно частыми симптомами является поражение кожи в виде экзантемы, кровоизлияний и отеков. Розовая пятнисто-папуллезная сыпь чаще располагается на конечностях, характеризуется периодическим появлением и исчезновением. Постоянными симптомами являются увеличение печени и селезенки с первых дней жизни ребенка или появляются в течение первого месяца жизни и часто сочетаются с затяжной желтухой и увеличением всех групп лимфатических узлов. Возможны диспепсические расстройства, пневмония, миокардит. Поражение ЦНС может не выявляться или отмечаются нерезко выраженные симптомы. Возможна сонливость или периодическое возбуждение, гипо- или гипертрофия мышц.
В особо тяжелых случаях болезнь сопровождается энцефалитом или менингоэнцефалитом. В ликворе повышено содержание общего белка, лимфоцитарный цитоз, ксантохромия. В крови у большинства детей отмечается лимфоцитоз и эозинофилия, возможна тромбоцитопения. При прогрессировании болезни может наступить летальный исход.
Лабораторно у детей отмечаются высокий лейкоцитоз, моноцитоз и эозинофилия, причем при сочетанном инфицировании с цитомегаловирусом, вирусом герпеса или бактериальной флорой изменения со стороны крови более выражены. При тяжелой форме острого токсоплазмоза может быстро нарастать лейкоцитоз.
Обнаружение антител класса IgM позволяет дифференцировать активную инфекцию от латентно протекающей. IgM к токсоплазмам можно выявить уже с первой недели после инфицирования. Интерпретация иммунологических показателей осложняется тем, что по ходу токсоплазмозной инвазии образуются антитела различного типа, и динамика их может быть неодинаковой и несинхронной.
Положительный результат однократного обследования по IgG-omeemy свидетельствует только о том, что обследуемый пациент был инфицирован токсоплазмами. Отрицательный результат свидетельствует лишь об отсутствии инфекции у пациента, но возможны серонегативные случаи у новорожденных и детей раннего возраста, а также у лиц с выраженным иммунодефицитом.
У иммунодефицитных больных повышение уровня IgG-антител и выявление специфических IgM наблюдается редко. У больных с иммунодефицитными состояниями, в том числе у новорожденных и детей раннего возраста, у которых варьирует антителообразование и часто не обнаруживаются IgM, порой единственным доказательством токсоплазмоза может стать определение эндозоитов, ДНК или антигенных компонентов в ткани мозга или спинномозговой жидкости при использовании РИФ или ПЦР. В связи с этим, видится перспективным в случае элиминации погибших плодов проведение исследования их ткани методом ПЦР на наличие ДНК паразита и других возбудителей (цитомегаловируса, вируса простого герпеса, вируса краснухи). Исследование кусочков плаценты из наиболее поврежденных её участков в случае получения позитивных результатов на наличие ДНК возбудителей позволит оперативно установить врожденную патологию или включить детей таких матерей в группу высокого риска заболевания с проведением своевременной адекватной терапии.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
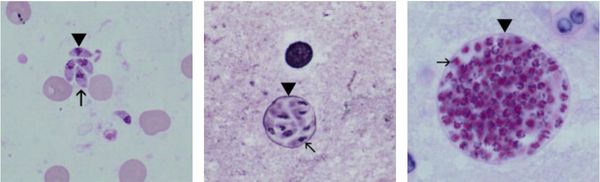
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
Патогенез токсоплазмоза
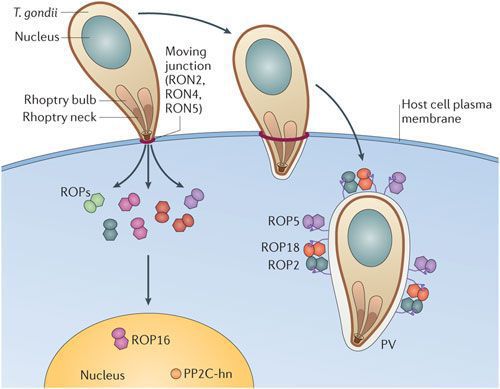
Входные ворота токсоплазмоза — ротовая полость, оттуда ооцисты попадают в кишечник человека. Далее при развитии паразита (делении его клеток) образуются трофозоиты, которые мигрируют в различные органы и ткани (преимущественно в ЦНС и мышечную). В клетках они формируют псевдоцисты — большое количество размножающихся паразитов.
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
По клиническим признакам выделяют пять форм заболевания:
По степени тяжести заболевание бывает:
По наличию осложнений выделяют:
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]