сеть хиари в правом предсердии что это такое
Структурные аномалии сердца с позиций анатомоморфологического и ультразвукового исследования
Дата публикации: 04.09.2018 2018-09-04
Статья просмотрена: 1986 раз
Библиографическое описание:
Жерко, Л. В. Структурные аномалии сердца с позиций анатомоморфологического и ультразвукового исследования / Л. В. Жерко, Л. А. Давыдова. — Текст : непосредственный // Молодой ученый. — 2018. — № 35 (221). — С. 22-26. — URL: https://moluch.ru/archive/221/52510/ (дата обращения: 07.12.2021).
Термин структурные или малые аномалии сердца (САС) объединяет все гемодинамически малозначимые аномалии соединительнотканного каркаса и клапанного аппарата сердца [1]. САС являются проявлением наследственно-обусловленных, многофакторных врожденных нарушений соединительной ткани. Наследственные нарушения соединительной ткани представляют собой гетерогенную группу заболеваний, обусловленных генетическими дефектами синтеза и/или распада белков внеклеточного матрикса либо нарушениями морфогенеза соединительной ткани. Выделяют синдромальные моногенные формы с согласованными критериями и несиндромальные формы мультифакториальной природы [2]. К моногенным наследственным синдромам относят синдромы Марфана, Элерса-Данло, гипермобильности суставов, несовершенного остеогенеза, пролапса митрального клапана, семейный синдром марфаноидной внешности (синдром Луиса-Дитца) и др. У пациентов с моногенными наследственными синдромами с согласованными критериями определяются множественные САС. К мультифакториальным несиндромным формам относят марфаноподобный, элерсоподобный и неклассифицируемый фенотипы, не имеющие на сегодняшний день точного молекулярно-генетического подтверждения. Поскольку соединительная ткань есть во всех органах и тканях, многообразие клинической симптоматики при наследственных и многофакторных нарушениях соединительной ткани является следствием изменения структуры, метаболизма и, следовательно, функции соединительной ткани [1].
Выявление определенных САС не должно рассматриваться только как эхокардиографическая находка, а требует комплексной оценки пациента с позиций имеющихся фенотипических критериев наследственных нарушений соединительной ткани для своевременной их диагностики, при некоторых из которых течение САС имеет более неблагоприятный прогноз [1].
В настоящее время не существует общепринятой классификации САС, структурировать которую при современном уровне знаний крайне затруднительно. Наиболее целесообразным представляется объединение ограниченного числа САС по анатомическому, этиологическому принципу и однотипности клинических осложнений [1]. В связи с этим были выделены предсердные САС — аневризма межпредсердной перегородки, открытое овальное окно, Евстахиев клапан, сеть Киари, отдельно — пролапсы клапанов, миксоматозная дегенерация клапанов, аномально расположенные хорды. Внесение в классификацию перечисленных САС определяется их сопряженностью с риском серьезных осложнений и ассоциированных состояний.
Целью данного исследования явилось изучение распространенности, анатомоморфологических и ультразвуковых признаков структурных аномалий сердца: открытого овального окна, аневризмы межпредсердной перегородки, сети Киари, Евстахиева клапана, миксоматозной дегенерации створок митрального клапана, аномально расположенных хорд левого желудочка.
В рамках выполнения работы проведено анатомоморфологическое исследование структурных аномалий сердца на 54 анатомических препаратах сердца, полученных на кафедре нормальной анатомии БГМУ. Выполнено ультразвуковое исследование сердца у 30 пациентов кардиологического профиля учреждения здравоохранения «1 городская клиническая больница» г. Минска. Возраст исследованных пациентов составил от 31 до 73 лет, средний возраст — 57 лет. Проанализированы сканограммы и протоколы эхокардиографии, выполненной 100 пациентам, из архива кафедры ультразвуковой диагностики БелМАПО.
Использованы анатомоморфометрический и статистический методы. Ультразвуковое исследование сердца выполнялось пациентам кардиологического, ревматологического и инфарктного отделений учреждения здравоохранения «1 городская клиническая больница» г. Минска на ультразвуковых аппаратах Siemens Acuson S1000, Toshiba Aplio XG, GE Volusson 730 Expert секторными датчиками с частотой сканирования 2,5‒5 МГц.
При осмотре анатомических препаратов сердец, полученных на кафедре нормальной анатомии БГМУ, в 3,7 % случаев было обнаружено открытое овальное окно (ООО) в виде щелевидного отверстия, расположенного по передневерхней кромке овальной ямки, имевшего туннелеподобное строение и косое направление. ООО по данным эхокардиографии (ЭхоКГ) диагностировано у 3,3 % пациентов при локации кровотока в режиме цветового допплеровского картирования в виде низкоскоростного сброса крови через межпредсердную перегородку в области овальной ямки без признаков перегрузки правых отделов сердца (дилатации, повышения давления в правом предсердии и желудочке, легочной артерии). По данным архива ООО было диагностировано в 9 % случаев, в том числе в 2 % в сочетании с другими САС (сочетание аневризмы межпредсердной перегородки, открытого овального окна и сети Киари).
Наиболее часто с ООО ассоциируются парадоксальная венозная эмболия и мигрень с аурой. К более редким ассоциированным с ООО состояниям относят транзиторную глобальную амнезию, протромботические нарушения, декомпрессионную болезнь, синдром обструктивного ночного апноэ. Частота выявления ООО при криптогенном инсульте крайне высока и составляет от 24 до 66 % случаев [1,3].
Аневризма межпредсердной перегородки (АМПП) по данным морфологического исследования составила 11,1 % случаев, представляла собой мешковидное выпячивание перегородки в зоне овальной ямки в полость правого предсердия глубиной более 1 см, без признаков межпредсердной коммуникации в виде открытого овального окна или дефекта межпредсердной перегородки. АМПП по данным ЭхоКГ была диагностирована в 3 % случаев, из них в 2 % наблюдений структурные аномалии сердца носили множественный характер.
При наличии АМПП и ООО существенно повышается риск развития инсультов, причем риск для лиц младше 55 лет выше при АМПП, чем при изолированном ООО, максимально увеличивается при сочетании АМПП и ООО. Вероятность повторного криптогенного инсульта при сочетании АМПП и ООО увеличивается в 7 раз по сравнению с риском инсульта при изолированном ООО [4].
При анатомоморфологическом исследовании в 5,5 % случаев была обнаружена сеть Киари, представляющая собой сетчатую мембраноподобную структуру с множественными отверстиями и двумя вариантами крепления: с фиксацией к двум зонам ‒ к краю устья нижней полой вены и эндокарду правого предсердия или овальной ямки (3,7 % случаев); и в виде дубликатуры пристеночного эндокарда с множественными точками крепления к эндокарду правого предсердия и распространением от нижней полой вены до овальной ямки (1,8 % случаев). Сеть Киари по данным ЭхоКГ была диагностирована в 3,3 % наблюдений в виде мобильной гиперэхогенной извитой структуры, с хаотичным движением в полости правого предсердия, исходящей от устья нижней полой вены и крепящейся к МПП в области овальной ямки. По данным архива сеть Киари встречалась в 2 % исследований в сочетании с аневризмой межпредсердной перегородки и открытым овальным окном.
Клиническое значение сети Киари заключается в повышении риска развития тромбоэмболии, инфекционного эндокардита; проблемах при внутрисердечных эндоваскулярных вмешательствах.
В 7,4 % случаев при анатомоморфологическом исследовании был выявлен Евстахиев клапан (ЕК). В одном препарате сердца размер ЕК составил 2,5 см, ЕК ограничивал устье нижней полой вены, имел полулунную форму, мембранозный тип строения. В остальных случаях длина ЕК была около 1 см. По данным архива кафедры ультразвуковой диагностики БелМАПО в 1 % выполненных ЭхоКГ был диагностирован удлиненный ЕК.
При возникновении право-левого сброса крови через межпредсердную перегородку удлиненный ЕК может способствовать возрастанию риска парадоксальной эмболии, ассоциированной с ООО. При одновременном сочетании трех аномалий — удлиненного ЕК, АМПП и ООО — у молодых лиц часто отмечают клинические проявления в виде цефалгического синдрома, синкопальных состояний, которые опосредованно могут рассматриваться как следствие микротромбозов в большом круге кровообращения [1]. ЕК может являться субстратом для образования тромбов, что ассоциируется c легочным тромбоэмболизмом. Удлиненный ЕК предрасполагает к суправентрикулярным аритмиям, с наиболее вероятным рефлекторным патофизиологическим механизмом вследствие раздражения пейсмекерных образований предсердия [1,5].
В 14,8 % препаратов сердца было обнаружено миксоматозное изменение митрального клапана, из них в 5,5 % наблюдений ‒ сочетание миксоматозной дегенерации митрального и трикуспидального клапанов. Створки были увеличены, утолщены по краям, бледно-серого цвета. Края створок закручены, с множественными аневризматическими выпячиваниями в виде «парашютов» или аневризм. В 3,7 % случаев были выявлены макроскопические признаки фиброэластиновой недостаточности в виде выраженного истончения створок митрального клапана, в особенности краевой зоны среднего сегмента задней створки. В одном из случаев наблюдалось сочетание фиброэластиновой недостаточности с миксоматозным изменением клапана.
При миксоматозной дегенерации створки митрального клапана по данным ЭхоКГ выглядят парашютообразными, удлиненными, неровными, утолщенными. Характерно их патологическое пролабирование в систолу в полость левого предсердия. На створках образуются округлые выпячивания — фестоны, аневризмы. В патологический процесс вовлекаются обе створки, с преимущественным поражением задней. Наличие миксоматозной деформации оценивается на основании толщины створки митрального клапана, измеренной в фазу диастолы в средней части створки вне зоны отхождения хорд. Общепринятые нормативы толщины створок 2–4 мм, увеличение более 5 мм свидетельствует о миксоматозной дегенерации [1]. По данным архива миксоматозная дегенерация створок отмечалась в 2 % случаев. Миксоматозная дегенерация створок митрального клапана обусловила формирование у обследованных пациентов пролапсов митрального клапана II и III степеней, умеренную-тяжелую и тяжелую митральную регургитацию.
В 31,5 % случаев при анатомоморфологическом исследовании обнаружены аномально расположенные хорды (АРХ) левого желудочка. В нашем исследовании в 25,9 % наблюдений выявлены следующие варианты крепления АРХ: от основания папиллярной мышцы к трабекуле стенки левого желудочка, к трабекулам стенок левого желудочка, от створки митрального клапана к стенке. В 3,7 % наблюдений имел место вариант крепления АРХ от створки митрального клапана к стенке или от створки клапана к межжелудочковой перегородке. Типичным вариантом строения АРХ левого желудочка были многочисленные точки прикрепления (более 2) к структурам сердца. По данным ЭхоКГ частота АРХ составила 20 %, преобладали срединно расположенные поперечные хорды и срединно-апикальные диагональные хорды.
АРХ при микроскопическом исследовании в большинстве случаев имеют травматическое повреждение, локальный и распространенный фиброз, кальциноз, миксоматоз [6]. В мышечных АРХ определяются Пуркинье-подобные клетки. В зонах прикрепления АРХ по данным морфологического исследования наблюдаются нарушения регионарного кровотока: «упругие» свойства АРХ препятствуют расслаблению миокарда в период диастолы, неполноценная диастола не обеспечивает нормальный кровоток в коронарных сосудах, натяжение АРХ ухудшает субэндокардиальный кровоток; синдром гемодинамического перераспределения или «обкрадывания», обусловленный наличием в АРХ артерий различного диаметра и последующим их спазмом при тракции тяжа [7]. АРХ в большинстве случаев сочетаются с другими САС.
Таким образом, структурные аномалии сердца являются аномалиями строения сердца, отличающимися от нормального анатомического строения, диагностируемыми эхокардиографически и морфологически, с доказанной клинической значимостью. Типичен множественный характер структурных аномалий в одном сердце.
Сеть хиари в правом предсердии что это такое
Клиническая картина характеризуется выраженными симптомами право- или левожелудочковой недостаточности. У части больных появляется выпот в полости перикарда, при ЭхоКГ отмечается также сравнительно небольшой объем желудочков, обусловленный выраженной инфильтрацией эндокарда желудочков и значительными фибринозными и тромботическими наложениями. Несмотря на повышение давления наполнения желудочков, систолическая функция их вначале сохраняется. Кроме того, при ЭхоКГ предсердия часто расширены, отмечается недостаточность митрального клапана и клапана легочной артерии.
б) Внутренние структуры правых отделов сердца. В правом предсердии имеются анатомические структуры, которые можно принять за объемное образование, поэтому их следует включить в дифференциальный диагноз. К таким структурам относятся евстахиева заслонка, пограничный гребень, сеть Хиари и мышечный пучок в устье верхней полой вены.
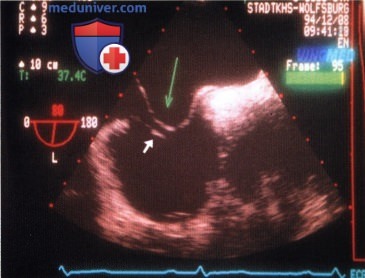
1. Сеть Хиари. Сеть, или пластинка Хиари представляет собой продырявленную мембрану, которая при нарушении процесса обратного развития правой заслонки венозного синуса сохраняется в правом предсердии в качестве анатомического варианта его строения. Сеть Хиари при ЭхоКГ была впервые описана в 1981 г. в виде очень подвижного образования со значительной вариабельностью места прикрепления. При ЧПЭ сеть Хиари, как правило, имеет вид перепончатого флотирующего образования в правом предсердии, которое прикрепляется к его медиальной и латеральной стенкам. Для исследования этого образования датчик, находящийся в пищеводе, проталкивают примерно на 4 см от плоскости четырех камер и поворачивают.
Частота выявления сети Хиари при ЧПЭ такая же, как при аутопсии, и составляет 5%. Несмотря на отдельные сообщения в литературе о связи сети Хиари с тромбозом правого предсердия, нарушением ритма сердца или образованием аневризмы межпредсердной перегородки, а также несмотря на казуистические случаи обвития тромба или катетера сетью Хиари, эта аномалия развития, как правило, не имеет клинического значения. Эхокардиография в таких случаях позволяет отдифференцировать сеть Хиари от других патологических образований правого предсердия, в частности тромба, вегетаций, инородного тела и редко аневризмы синуса Вальсальвы.
2. Трехпредсердное сердце (удвоение правого предсердия). Персистенция правой заслонки венозного синуса может привести к образованию патологической мембраны и удвоению правого предсердия (правое трехпредсердное сердце).
3. Евстахиева заслонка. Евстахиева заслонка, или евстахиев клапан, расположена в устье нижней полой вены и хорошо визуализируется при лоцировании сердца вдоль длинной оси из чреспищеводного доступа.
4. Тебезиев клапан (заслонка) и пограничный гребень. Вблизи венозного синуса расположены также тебезиев клапан и пограничный гребень. Тебезиев клапан прикрепляется к устью коронарного синуса, а пограничный гребень расположен на латеральной стенке правого предсердия. Для идентификации этих структур правого предсердия и дифференцирования их от перечисленных выше объемных образований, как правило, необходимо выполнение многопроекционного УЗИ и, по крайней мере, двумерной ЭхоКГ.
5. Гребешковые мышцы и мышечные пучки. Стенки правого предсердия по сравнению с левым имеют более выраженное трабекулярное строение, и иногда отдельные трабекулы или мышечные пучки бывают настолько крупными, что их приходится включать в дифференциальный диагноз, когда у больного подозревают опухоль предсердия. Указанные анатомические структуры могут особенно увеличиваться при гипертрофии предсердий, например при дефекте межпредсердной перегородки. У устья верхней полой вены иногда наблюдается мышечный пучок, который также может затруднить диагностику и должен быть учтен в дифференциальном диагнозе.
В большинстве случаев эти структуры при многопроекционном чреспищеводном исследовании оказываются нормальным анатомическим вариантом; для большей информативности исследования в горизонтальной (поперечной) плоскости датчик желательно продвинуть несколько дальше или же подтянуть.
Менее затруднительна идентификация так называемой модераторной трабекулы в правом желудочке; ее можно выявить и при трансторакальной ЭхоКГ.
6. Тромбы. При образовании тромбов в правом предсердии или желудочке так или иначе нарушается функция этих камер сердца (мерцание предсердий, дилатационная кардиомиопатия). Лишь в исключительных случаях у больных со злокачественной опухолью сердца или нарушением свертывания крови тромбы могут образоваться без нарушения функции пораженного предсердия или желудочка. Тромбы в правые отделы сердца могут мигрировать также из глубоких вен нижних конечностей или из тазовых вен при их тромбозе.
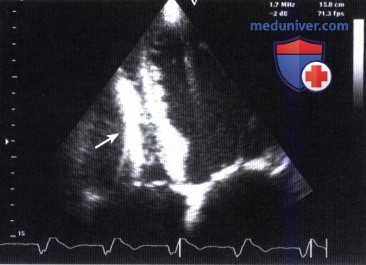
7. Ятрогенные структуры, образующиеся в сердце. Ятрогенными структурами в правых отделах сердца, которые иногда ошибочно принимают за объемное образование, могут быть электрод от электрокардиостимулятора или имплантируемого дефибриллятора, а в исключительно редких случаях также катетеры для эмболизации артерий и кава-фильтры. В этих случаях также необходимо правильно оценить клиническую ситуацию в целом и собрать подробный анамнез.
в) Дополнительные структуры левых отделов сердца:
1. Мышечные пучки и сухожильные хорды. К дополнительным анатомическим структурам левых отделов сердца, которые следует учитывать при проведении дифференциальной диагностики, относятся аномальные сосочковые мышцы и аберрантные сухожильные хорды. Выраженная трабекулярность внутреннего рельефа левых камер сердца или гипертрофия их стенки могут вызвать при ЭхоКГ подозрение на опухоль сердца.
2. Фиброз и обызвествление. В дифференциальной диагностике следует учесть также очаговый фиброз и обызвествление желудочковой стенки, а нередко и области митрального кольца. Полноценное УЗИ, включая трансторакальную ЭхоКГ, в том числе из подреберной позиции датчика, а при необходимости и ЧПЭ, как правило, дает возможность четко дифференцировать эти изменения от опухоли сердца, от тромба и вегетаций.
3. Трехпредсердное сердце (удвоение левого предсердия). Резидуальная ткань общей легочной вены может достигать значительных размеров, располагаясь от устья левой верхней легочной вены до входа в ушко левого предсердия. В результате левое предсердие оказывается как бы разделенным на две камеры (левое трехпредсердное сердце).
4. Другие структуры сердца. За опухоль левого предсердия можно по ошибке принять также грыжу пищеводного отверстия диафрагмы, крупную аневризму коронарной артерии или увеличенный коронарный синус. Локализованная гематома перикарда также может создать впечатление опухоли сердца. В дифференциальный диагноз следует включить также пролапс митрального клапана, вегетации, связанные с эндокардитом, а также разрастания Ламбла на митральном клапане(см. рис. 22.10).
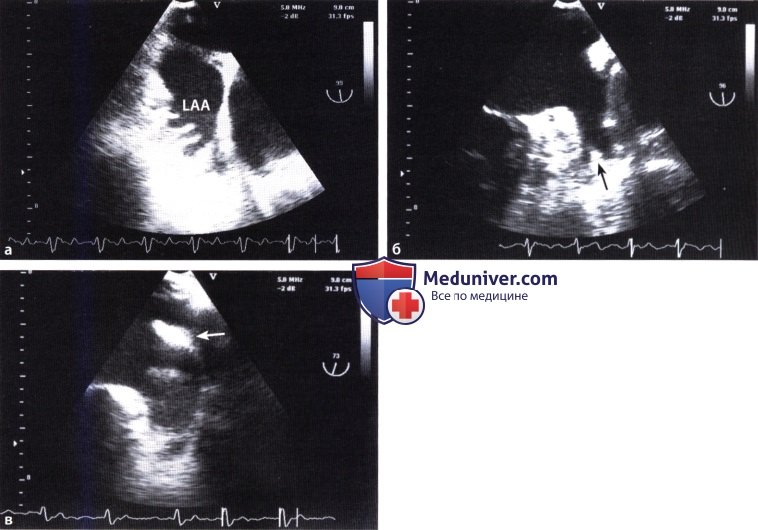
а ЧПЭ: гребешковые мышцы в левом ушке.
б Ушко левого предсердия, разделенное перегородкой (стрелка).
в Утолщенная складка свободной стенки правого желудочка (симптом «ватной палочки») (стрелка).
5. Тромбы. Диагностику тромба в левом предсердии могут усложнить гипертрофированные гребешковые мышцы, патологические эхо-сигналы от крыши левого предсердия в области входа в ушко или резидуальная ткань у устья левой верхней легочной вены. Для проведения дифференциальной диагностики следует выполнить многопроекционную ЧПЭ, а также допплерографию в импульсном режиме, которая позволяет измерить скорость кровотока в ушке левого предсердия. В присутствии тромба кровоток в левом ушке отчетливо снижается и составляет значительно меньше 25 см/с.
Для распознавания тромбоза левого ушка и проведения дифференциальной диагностики следует знать морфологические особенности левого предсердия. Нередко левое ушко состоит из двух или трех отделов, отделенных перегородками, которые также могут создать ложное впечатление тромбоза ушка. Источником диагностической ошибки может стать также образование складки (симптом «ватной палочки») на свободной стенке левого предсердия, впечатление тромбоза может создать также сканирование в косой плоскости к стенеи левого предсердия при переходе ее в крышу предсердия. Во многих случаях ошибочной диагностике тромбоза способствует недостаточный опыт врача-сонолога. Частота ошибочных диагнозов может достигать 60-70%.

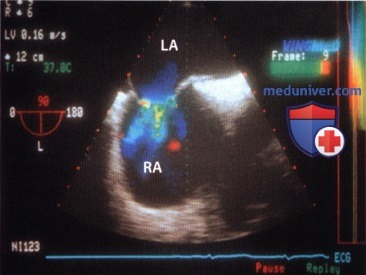
г) Аневризмы межпредсердной перегородки:
Согласно определению, под аневризмой обычно понимают выпячивание межпредсердной перегородки в правое или левое предсердие более чем на 10 мм, хотя нередко наблюдаются случаи, когда межпредсердная перегородка смещается в сторону то одного, то другого предсердия. Аневризма может охватывать всю межпредсердную перегородку или только область овальной ямки.
2. Эхокардиография. По данным одного исследования, охватившего 195 больных, аневризму межпредсердной перегородки менее чем в 50% случаев диагностируют с помощью трансторакальной ЭхоКГ и в большинстве случаев диагноз ставят по результатам ЧПЭ. Из 195 больных у половины аневризма охватывала всю межпредсердную перегородку. Более чем в 50% случаев наблюдался сброс крови преимущественно через овальное окно. В отдельных случаях отмечены множественные перфорации аневризматически измененной межпредсердной перегородки, которая напоминала «швейцарский сыр».
3. Эмболии. У 44% больных с аневризмой межпредсердной перегородки и сбросом крови на уровне предсердий в анамнезе отмечаются эпизоды эмболии. У четверти больных, перенесших эмболию, помимо аневризмы межпредсердной перегородки, других возможных источников кардиогенной эмболии не выявляют. Ни размер аневризмы, ни степень ее выпячивания на частоту эмболии не влияют. Но у больных, перенесших эмболию, сброс крови через аневризму межпредсердной перегородки наблюдается существенно чаще. По данным специального исследования «Patent Foramen Ovale and Atrial Septal Aneurysm», при одном лишь открытом овальном окне риск повторного инсульта составляет 2,3%.
Если имеется также аневризма межпредсердной перегородки, риск возрастает до 15,2%. Эти данные говорят об особенно важном клиническом значении парадоксальной эмболии при аневризме межпредсердной перегородки со сбросом крови. В то же время тромбоз аневризмы как источник эмболии существенной роли не играет, так как лишь у 2 больных из 195 был выявлен тромб. Поэтому поиск аневризмы межпредсердной перегородки у лиц молодого возраста, перенесших инсульт, имеет основополагающее значение в установлении этиологического диагноза и особенно для правильного лечения.
Редактор: Искандер Милевски. Дата публикации: 11.1.2020
Современная эхокардиография, шумы в сердце, беременные женщины и дайвинг
УЗИ сканер HS70
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Опыт работы в лечебно-диагностическом центре «Арт-Мед» позволяет разделить пациентов, которые приходят на эхокардиографию, на определенные группы, в зависимости от причин их обращения.
Первую категорию составят беременные женщины, поскольку эхокардиографическое исследование считается обязательным и входит в план обследования. Вторую, многочисленную категорию, составят люди молодого возраста с кардиалгиями. Третью группу составят больные с хронической патологией сердца, нуждающиеся в динамическом наблюдении (врожденные и приобретенные пороки и т.д.) или в уточнении диагноза.
Четвертую группу составят больные с впервые возникшими жалобами на боли в области сердца, одышку, проявления сердечной недостаточности. Данная группа пациентов наиболее серьезная, т.к. среди них можно встретить «острую» патологию (аневризма грудной восходящей аорты, тромбоэмболия в систему легочной артерии, развитее аневризмы левого желудочка и т.д.). Пятую группу составят пациенты с шумом в области сердца. Попытаемся объяснить возможности эхокардиографии в диагностике патологии сердца и дифференциальной диагностике. Для этого попытаемся проанализировать вышеперечисленные группы пациентов.
Эхокардиография при беременности
Рис. 1. Незначительный пролапс передней створки митрального клапана (вариант нормы).



