сгорание железа в кислороде что делали что наблюдали вывод
Ответ на Параграф 25 Практическая работа №3 из ГДЗ по Химии 8 класс: Рудзитис Г.Е.
Условие
Практическая работа 3
Получение и свойства кислорода
повторите правила техники безопасности при работе в химическом кабинете.
1. Получение и собирание кнаюрола
а) Соберите прибор, как показано на рисунке 25 (с. 73). и проверьте его на герметичность. В пробирку насыпьте перманганат калия примерно на 1/4 её объёма и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Закрепите пробирку н лапке штатива гак. чтобы коней газоотводной трубки почти доходил до дна стакана или цилиндра, и которой будет собираться кислород.
В пламени спиртовки сначала обогрейте всю пробирку, а затем нагревайте ее дно.
Полноту заполнения стакана (цилиндра) кислородом проверяйте тлеющей лучинкой. Как только сосуд наполнится кислородом, закройте его картоном или стеклянной пластинкой.
б) Соберите прибор, как показано на рисунке 26 (с. 74), и проверьте его на герметичность. В сосуд с водой опрокиньте пробирку с водой (или цилиндр, закрытый стеклянной пластинкой). Затем пробирку (цилиндр) с бодой наденьте на конец газоотводной трубки и шире войте пробирку с перманганатом калия. Когда сосуд заполнится кислородом, закройте его иод водой стеклянной пластинкой.
2. Горение в кислороде угля и серы
а) Положите в железную ложечку кусочек древесного угля и раскалите его в пламени спиртовки. Затем ложечку с тлеющим утлем внесите в сосул с кислородом и наблюдайте з» происходящим. Кош горение прекратится, илейте в сосуд немного известковой воды и взболтайте. Почему известковая вода мутнеет’ Запишите уравнение реакции юрения угля.
б) В железную ложечку положите кусочек серы и подожгите ею в пламени спиртовки. (Опыт провозится в вытяжном шкафу!) Понаблюдайте, как сера горит на воздухе. Затем поместите горящую серу в сосуд с кислородом. Как изменилось атамя? Почему? Запишите уравнение реакции юрения серы.
3. Отчёт о работе оформите в зиле таГшшы (см. § 5).
Что делали
Собрали установку как на рисунке, полноту заполнения стакана кислородом проверяли, вводя в него тлеющую лучинку.
Собрали установку как на рисунке, методом вытеснения воды наполнили пробирку кислородом.
Раскалили в пламени спиртовки древесный уголь, внесли его в пробирку с кислородом. Затем наполнили пробирку известковой водой и взболтали.
Подожгли кусочек серы в пламени спиртовки. Затем внесли серу в пробирку с кислородом.
Что наблюдали
Через некоторое время после начала реакции тлеющая лучина, введенная в стакан, загоралась.
По мере образования кислорода уровень воды в пробирке опускался.
Уголь горит в кислороде. Известковая вода помутнела.
Сера горит на воздухе медленно, в кислороде – интенсивно, синим пламенем. При этом появляется резкий запах.
Выводы
Получить кислород в лаборатории можно разложением перманганата калия:
О выделении кислорода можно судить по воспламеняющейся лучине (кислород поддерживает горение).
Кислород – газ, поэтому с увеличением его концентрации в пробирке возрастает давление, в результате чего, кислород вытесняет воду, наполняя пробирку.
Уголь горит в кислороде с образованием углекислого газа.
Помутнение известковой воды – качественная реакция на углекислый газ, что подтверждает, что горение угля происходит согласно этому уравнению реакции.
В воздухе концентрация кислорода небольшая – всего 21%. Поэтому сера горит в чистом кислороде гораздо интенсивнее.
Появление резкого запаха свидетельствует об образовании оксида серы (IV) в процессе горения серы в кислороде.
Характеристики железа и его реакция с кислородом
Как железо взаимодействует с кислородом
Химические и физические свойства железа
При нормальных условиях и в чистом виде железо — твердое вещество серебристо-серого цвета с ярким металлическим блеском. Железо — хороший электро- и теплопроводник. Это можно ощутить, дотронувшись в холодном помещении к железному предмету. Так как металл быстро проводит тепло, за короткий отрезок времени железо забирает большую часть тепла из человеческой кожи, поэтому во время прикосновения к нему ощущается холод.
Температура плавления железа — 1538 °С, температура кипения — 2862 °С. Характерные свойства железа — хорошая пластичность и легкоплавкость.
Железо реагирует с простыми веществами: кислородом, галогенами (бромом, йодом, фтором, хлором), фосфором, серой. При сжигании железа образуются оксиды металла. В зависимости от условий проведения реакции и пропорций между двумя участниками, оксиды железа могут быть разнообразными. Уравнения реакций:
Подобные реакции идут при высоких температурах. Здесь вы узнаете, какие опыты на изучение свойств железа можно провести дома.
Реакция железа с кислородом
Для реакции железа с кислородом необходимо предварительное нагревание. Железо сгорает ослепительным пламенем, разбрасывая искры — раскаленные частицы железной окалины Fe₃O₄. Такая же реакция железа и кислорода происходит и на воздухе, когда сталь при механической обработке сильно нагревается от трения.
При сгорании железа в кислороде (или на воздухе) образуется железная окалина. Уравнение реакции:
Железная окалина — соединение, в котором железо имеет разные значения валентности.
Получение оксидов железа
Оксиды железа — это продукты взаимодействия железа с кислородом. Наиболее известные из них — FeO, Fe₂O₃ и Fe₃O₄.
Оксид железа (III) Fe₂O₃ — оранжево-красный порошок, образующийся при окислении железа на воздухе.
Вещество образуется при разложении соли трехвалентного железа на воздухе при высокой температуре. В фарфоровый тигель насыпается немного сульфата железа (III), а затем прокаливается на огне газовой горелки. При термическом разложении сульфат железа распадется на оксид серы и оксид железа.
Оксид железа (II, III) Fe₃O₄ образуется при сжигании порошкообразного железа в кислороде или на воздухе. Для получения оксида в фарфоровый тигель насыпается немного смешанного с нитратом натрия или калия тонкого железного порошка. Смесь поджигается газовой горелкой. При нагревании нитраты калия и натрия разлагаются с выделением кислорода. Железо в кислороде горит, образуя оксид Fe₃O₄. После окончания горения полученный оксид остается на дне фарфоровой чашки в виде железной окалины.
Внимание! Не пытайтесь повторить эти опыты самостоятельно!
Оксид железа (II) FeO — это черный порошок, который образуется при разложении оксалата железа в инертной атмосфере.
9 класс. Презентация: Практическая работа на тему » Решение экспериментальных задач по теме «Металлы и их соединения».
Выбранный для просмотра документ практическая работа 7.pptx
Описание презентации по отдельным слайдам:
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №11» ЛЕВОКУМСКОГО МУНИЦИПАЛЬНОГО РАЙОНА СТАВРОПОЛЬСКОГО КРАЯ Практическая работа Решение экспериментальных задач по теме «Металлы и их соединения» Учитель Вакула Ю.С. С. Владимировка 2019
Цель: изучить и закрепить знания о свойствах металлов и их соединениях Задача №1. Свойства железа и его соединений. Осуществите превращения по схеме: Fe → Fe3O4 → Fe → FeCl3 → Fe(OH)3 → FeCl3 Задача №2. Способы устранения жёсткости воды. В стакане жесткая вода,которая содержит сульфат магния и гидрокарбонат кальция. Какими ионами обусловлена постоянная, а какими временная жесткость воды? Предложите способы, при помощи которых можно устранить постоянную и временную жесткость воды.
Правила техники безопасности 1. Проводите опыты лишь с теми веществами, которые указаны учителем. 2. Не пробуйте вещества на вкус. 3. При выяснении запаха не подносите сосуд близко к лицу. Для выяснения запаха нужно ладонью руки сделать движение от отверстия сосуда к носу. 4. Нагревая пробирку с жидкостью, держите ее так, чтобы открытый конец ее был направлен в сторону от себя и от соседа. 5. Опыты производите только над столом. 6. Нельзя переносить спиртовку во время работы в зажжённом виде с одного стола на другой. Тушить только колпачком – не дуть! 7. В случае пореза, ожога немедленно обращайтесь к учителю. 8. Обращайтесь бережно с посудой, веществами и лабораторным оборудованием. 9. Закончив работу, приведите рабочее место в порядок.
Ход работы Внимательно посмотрите следующие видео – эксперименты: 1) Сгорание железа в кислороде; 2) Получение железа алюминотермическим способом; 3) Взаимодействие хлора с железом; 4) Получение гидроксида железа (III) и взаимодействие его с кислотами 5)Способы устранения жесткости воды
1) Сгорание железа в кислороде
2) Получение железа алюминотермическим способом
3)Взаимодействие хлора с железом
4) Получение гидроксида железа (III) и взаимодействие его с кислотами
5)Способы устранения жесткости воды
Задача 2 Что делали? Что наблюдали? Уравнение химической реакции. 1) Устранение гидрокарбонат – ионов HCO3- Сa(HCO3)2 t˚C→ Сa(HCO3)2+ Ca(OH)2 → 2) Устранение сульфат – ионов SO42- Запишите УХР в молекулярном полном и кратком ионном виде: MgSO4 + Na2CO3 →
Сделайте вывод: 1)Каким способом можно получить чистое железо? 2)Как распознать гидроксид железа (III)? 3)Какими ионами обусловлена постоянная, а какими временная жесткость воды? 4)Какие существуют способы, при помощи которых можно устранить постоянную и временную жесткость воды?
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-858806
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Каждый третий российский школьник хотел бы стать разработчиком игр
Время чтения: 2 минуты
В Ленобласти педагоги призеров и победителей олимпиады получат денежные поощрения
Время чтения: 1 минута
Для школьников к 1 сентября разработают короткие экскурсионные маршруты
Время чтения: 1 минута
Только каждый 10-й россиянин может дать платное образование своим детям
Время чтения: 2 минуты
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Практическая работа № 7 Химия 9 класс
Отчёт о практической работе № 7
Тема: Решение экспериментальных задач по теме «Металлы и их соединения»
Дата выполнения работы _________
Имя, Фамилия автора ___________
Цель работы: Изучить и закрепить знания о свойствах металлов и их соединениях
Задача №1. Свойства железа и его соединений.
Осуществите превращения по схеме:
Посмотрите следующие видео – эксперименты:
1) Сгорание железа в кислороде;
2) Получение железа алюминотермическим способом;
3) Взаимодействие хлора с железом;
4) Получение гидроксида железа ( III ) и взаимодействие его с кислотами
Оформите отчёт в виде таблицы:
Уравнение химической реакции.
1) Сгорание железа в кислороде
Запишите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель), процессы окисления (восстановления)
2) Получение железа алюминотермическим способом
Запишите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель), процессы окисления (восстановления)
3) Взаимодействие хлора с железом
Запишите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель), процессы окисления (восстановления)
4) Получение гидроксида железа ( III ) и взаимодействие его с кислотами
Запишите УХР в молекулярном полном и кратком ионном виде:
Задача №2. Определение качественного состава соли. Распознавание солей.
В двух неподписанных флаконах выданы растворы солей – сульфата алюминия и сульфита алюминия. Как при помощи характерных реакций распознать каждое из веществ?
Загрузите и внимательно посмотрите следующие видео – эксперименты:
1) Обнаружение ионов алюминия;
2) Качественная реакция на сульфит- и сульфат-ионы.
Раствор хлорида бария BaCl 2
Раствор азотной кислоты HNO 3
1) Сульфат алюминия
2) Сульфит алюминия
Запишите УХР в молекулярном полном и кратком ионном виде:
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-1104257
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Комиссия РАН призвала отозвать проект новых правил русского языка
Время чтения: 2 минуты
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Трехлетнюю олимпиаду среди школ запустят в России в 2022 году
Время чтения: 1 минута
В Москве новогодние утренники в школах и детсадах пройдут без родителей
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
В Ленобласти педагоги призеров и победителей олимпиады получат денежные поощрения
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Горение железа
Думаете, железо не горит?
Реагенты
Безопасность
Часто задаваемые вопросы
Ничего страшного! Просто сложите разорванные части ваты так, чтобы они прикасались друг к другу.
Обязательно подождите, пока вся установка с ватой внутри не остынет, а наклейка не почернеет. Железная вата абсолютно безопасна, и вы можете выкинуть ее с обычным бытовым мусором.
Скорее всего, недостаточно кислорода у поверхности железных ниток для возгорания. Распушите еще немного вату и попробуйте поджечь ее еще раз.
Другие эксперименты
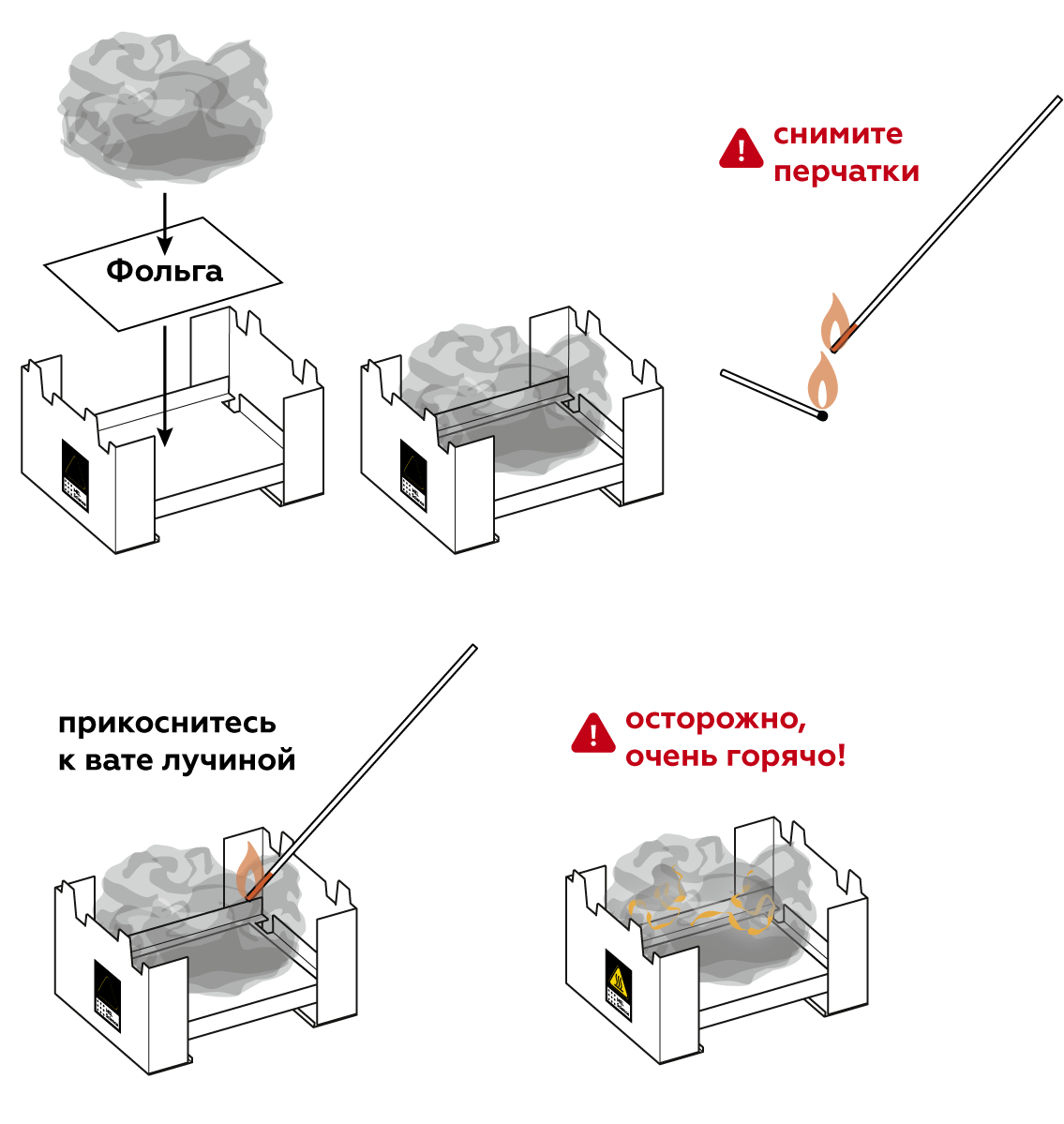
Пошаговая инструкция
Этот эксперимент лучше всего проводить в полутьме.
Железная вата делается из тонких железных нитей. Слегка распушите вату, чтобы кислород воздуха имел больше доступа к железу.
Будет горячо, поэтому сделайте в горелке дно из фольги и положите на него железную вату. Подожгите ее.
Утилизация
Утилизируйте твердые отходы эксперимента вместе с бытовым мусором.
Что произошло
Рельсы, гвозди и другие вещи, сделанные из железа, поджечь очень сложно — может даже показаться, что это совсем невозможно. При этом перед вашими глазами только что неплохо горели железные нити. В чем же секрет?









Это интересно
Чем отличаются железо и сталь?











Подпишитесь на наборы MEL Chemistry и проведите эти опыты у себя дома!