синдром мовата вильсона что это
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Болезнь Вильсона может протекать в брюшной, ригидно-аритмогиперкинетической, дрожательной или экстрапирамидно-корковой форме. Диагностика болезни Вильсона включает офтальмологическое обследование, биохимические анализы мочи и крови, МРТ или КТ головного мозга. Основу патогенетической терапии составляют тиоловые препараты, которые могут приниматься в течении нескольких лет и даже пожизненно.
МКБ-10
Общие сведения
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФ-азы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Первооткрыватель заболевания — А.К. Вильсон, описавший заболевание в 1912 году, в отечественной медицине — Н.А. Коновалов. Патогенез болезни Вильсона был выявлен в 1993 году. Понятию «болезнь Вильсона» соответствуют также: болезнь Вильсона-Коновалова, болезнь Вестфаля-Вильсона-Коновалова, дистрофия гепатоцеребральная, дистрофия гепатолентикулярная, дегенерация лентикулярная прогрессирующая.
Причины
Ген АТР7В картирован на длинном плече хромосомы 13 (13q14.3-q21.1). Организм человека содержит около 50-100 мг меди. Суточная потребность меди для человека — 1-2 мг. 95% абсорбированной в кишечнике меди, транспортируется в форме комплекса с церулоплазмином (один из глобулинов сыворотки, синтезируемых печенью) и только 5% в форме комплекса с альбумином. Кроме того, ион меди входит в состав важнейших метаболических ферментов (лизилоксидаза, супероксиддисмутаза, цитохром-С-оксидаза и др.). При болезни Вильсона происходит нарушение двух процессов обмена меди в печени — биосинтез главного медьсвязывающего белка (церулоплазмина) и выведение меди с желчью, следствием чего становится повышение уровня несвязанной меди в крови. Концентрация меди в различных органах (чаще всего в печени, почках, роговице и головном мозге) увеличивается, что приводит к их токсическому поражению.
Классификация
Согласно классификации Н.В. Коновалова различают пять форм болезни Вильсона:
Симптомы
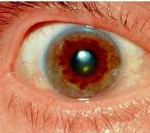
Для болезни Вильсона характерен клинический полиморфизм. Первые проявления заболевания могут появиться в детстве, юношестве, в зрелом возрасте и гораздо реже в зрелом возрасте. В 40-50% случаев Болезнь Вильсона манифестирует с поражения печени, в остальных — с психических и неврологических расстройств. С вовлечением в патологический процесс нервной системы обнаруживается кольцо Кайзера-Флейшера.
Брюшная форма развивается преимущественно до 40 лет. Характерный признак — тяжелое поражение печени по типу цирроза печени, хронического гепатита, фульминантного гепатита.
Ригидно-аритмогиперкинетическая форма манифестирует в детском возрасте. Начальные проявления — мышечная ригидность, амимия, смазанность речи, трудности при выполнении мелких движений, умеренное снижение интеллекта. Для этой формы заболевания характерно прогрессирующее течение, с наличием эпизодов обострения и ремиссии.
Дрожательная форма возникает в возрасте от 10 до 30 лет. Преобладающим симптомом является тремор. Кроме того, могут наблюдаться брадикинезия, брадилалия, тяжелый психоорганический синдром, эпилептические приступы.
Экстрапирамидно-корковая форма встречается весьма редко. Ее начало схоже с началом какой-либо из вышеперечисленных форм. Для нее характерны эпилептические припадки, экстрапирамидные и пирамидные нарушения и выраженный интеллектуальный дефицит.
Диагностика
Офтальмологическое исследование с помощью щелевой лампы выявляет кольцо Кайзера-Флейшера. Биохимические исследования мочи обнаруживают повышенную экскрецию меди в суточной моче, а также снижение концентрации церулоплазмина в крови. С помощью визуализационных методов (КТ и МРТ головного мозга) обнаруживают атрофию полушарий большого мозга и мозжечка, а также базальных ядер.
При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца. Основным дифференциально-диагностическим признаком этих заболеваний является отсутствие характерных для болезни Вильсона кольца Кайзера-Флейшера и расстройств обмена меди. Для подтверждения болезни Вильсона проводится генодиагностика.
Лечение болезни Вильсона
Основой патогенетического лечения является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола. Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов. Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза). Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца. В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов). В случае доминирования гиперкинезов рекомендовано назначение небольших курсов нейролептиков, при ригидности — леводопы, карбидопы, тригексифенидила.
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме. В дальнейшем лечение пациента составляет иммуносупрессивная терапия. В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень). Немедикаментозное лечение состоит в назначении диеты (стол №5) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т. д.).
Прогноз и профилактика
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме. Постоянный прием тиоловых препаратов по схеме, назначенной врачом-специалистом, позволяет поддерживать профессиональную и социальную активность пациента.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Моуат-Вильсон синдром
OMIM 235730
Наша команда профессионалов ответит на ваши вопросы
Синдром Моуат-Вильсона – аутосомно-доминантное заболевание, впервые описано в 1998 году. Клинические характеристики: умственная отсталость, микроцефалия, эпилепсия, низкий рост, врожденные сердечные нарушения, отсроченное моторное развитие. Для больных характерен типичный лицевой фенотип: гипертелоризм (увеличенное расстояние между внутренними краями глазниц), сходящееся косоглазие, широкая носовая перегородка, закругленный кончик носа, постоянно открытый рот, выступающий заостренный подбородок, повернутая назад ушная раковина. При магнитно-резонансном исследовании головного мозга часто обнаруживается гипоплазия или агенезия мозолистого тела (corpus callosum).
В 41-71% случаев у пациентов с синдромом Моуат-Вильсона обнаруживаются признаки болезни Гиршпрунга: отсутствие отхождения мекония в течение первых 24-48 часов жизни, метеоризм, увеличение окружности живота, боли в животе, стойкие запоры, рвота. Как правило, участок аганглиоза у данных больных небольшой. Синдром Моуат-Вильсона, наряду с другими заболеваниями, является несиндромальной формой болезни Гиршпрунга.
В 2001 году описан ген ZEB2 (ZFHX1B, SMADIP1), ответственный за развитие синдрома Моуат-Вильсона. Мутации в гене происходят de novo, как правило, это нонсенс мутации (приводящие к появлению преждевременного стоп-кодона) и мутации со сдвигом рамки считывания. Часто у больных обнаруживаются крупные делеции (от 0.2 до 10.4 млн.пар нуклеотидов) в области 2q22-q24.1, полностью или частично затрагивающие ген ZEB2.
В Центре Молекулярной генетики проводится поиск мутаций в гене ZEB2 методом автоматического секвенирования, а также цитогенетическое исследование для поиска крупных делеций.
Болезнь Вильсона у детей. Клинические рекомендации.
Болезнь Вильсона у детей
Оглавление
Ключевые слова
Список сокращений
БВ – болезнь Вильсона
МНО – международное нормализованное отношение
ОТП – ортотопическая трансплантация печени
ПИ – протромбиновый индекс
УЗИ – ультразвуковое исследование
ЩФ – щелочная фосфатаза
МРТ – магнитно-регонансная томография
КТ – компьютерная томография
Термины и определения
Хелатная терапия – способ лечения, заключающийся во введении препаратов, связывающих и выводящих из организма ионы тяжелых металлов.
Гепатомегалия – увеличение печени.
Спленомегалия – увеличение селезенки.
Стеатоз печени – наиболее распространенный гепатоз, при котором в печёночных клетках происходит накопление жира.
Фиброз печени – разрастание соединительной ткани органа, возникающее при чрезмерном накоплении белков внеклеточного матрикса (основы соединительной ткани).
Цирроз печени – хроническое заболевание печени, сопровождающееся необратимым замещением паренхиматозной ткани печени фиброзной соединительной тканью, или стромой.
1. Краткая информация
1.1 Определение
Болезнь Вильсона (БВ) относится к числу наиболее трудно диагностируемых заболеваний печени в связи с длительным латентным течением, особенно на начальных стадиях заболевания, и большим полиморфизмом клинической симптоматики. В связи с этим болезнь Вильсона необходимо исключать у каждого пациента детского и подросткового возраста с патологией печени неуточненной этиологии.
Своевременное назначение патогенетической терапии при болезни Вильсона у детей сопровождается регрессом клинической симптоматики, предотвращением формирования цирроза печени и неврологической симптоматики, улучшением качества жизни и социальной адаптации ребенка. В связи с этим важнейшей медицинской и социальной задачей является ранняя диагностика и адекватная терапия БВ 7.
Болезнь Вильсона (синонимы: болезнь Вильсона-Коновалова, гепатолентикулярная дегенерация, гепатоцеребральная дистрофия) – редкое наследственное заболевание, связанное с нарушением метаболизма меди и избыточным ее накоплением в различных органах и тканях, преимущественно проявляющееся симптоматикой поражения печени и центральной нервной системы 3.
1.2 Этиология и патогенез
ATP7B – ген экспрессируется, в основном, в печени и кодирует медьтранспортирующую АТФ-азу (АТФ-аза 7В, АТФ-аза 2, АТФ-аза Р-типа). Генетически детерминируемое снижение функции медь-транспортирующей АТФ-азы в результате молекулярных дефектов в гене АТР7В приводит к снижению гепатобилиарной экскреции меди и нарушению встраивания меди в церулоплазмин, в результате экскретируется и циркулирует апоцерулоплазмин (ненагруженный медью, срок полувыведения которого сокращается вдвое, что и объясняет гипоцерулоплазминемию), а медь накапливается в различных органах и тканях, преимущественно в печени, головном мозге, роговице глаза, почках, обеспечивая полиморфизм клинических появлений БВ. Вся циркулирующая (в сыворотке крови) медь связана церулоплазмином, а парадокс БВ, при которой отмечается низкий уровень меди в сыворотке крови при перегрузке тканей, объясняется низким уровнем церулоплазмина. При тяжелых формах БВ, протекающих с цитолизом, повышение концентрации меди до нормы и выше связано с распадом перегруженных медью гепатоцитов, свободная (не связанная церулоплазмином) медь крайне токсична и провоцирует гемолитические кризы 2.
В организм медь поступает в основном с пищей (табл.1). Наиболее богаты медью следующие продукты: печень, моллюски, крабы, креветки, устрицы, лобстеры, соевые бобы, шоколад, орехи.
Болезнь Вильсона-Коновалова
Поражение мозга приводит к развитию тяжелой неврологической симптоматики: дрожанию конечностей и всего туловища, повышению мышечного тонуса, иногда сопровождающемуся болезненными спазмами, нарушению речи и/или глотания, снижению интеллекта.
Дебют заболевания может быть в детском, подростковом, юношеском, зрелом возрасте и очень редко – в 50–60 лет. Чем раньше начинается заболевание, тем тяжелее оно протекает (при отсутствии лечения).
Диагностика основана на обнаружении признаков нарушения обмена меди в крови и моче (анализ крови на содержание меди и церулоплазмина в крови, суточный анализ мочи на медь). Реже проводится генетический анализ на обнаружение мутаций в гене АТР7В. Особое диагностическое значение имеет консультация офтальмолога для определения отложения меди в роговице (кольцо Кайзера-Флейшер).
Болезнь Вильсона–Коновалова – редкий пример наследственного нарушения, для которого разработаны высокоэффективные методы лечения. Назначаются специальные препараты, которые мешают попаданию меди в организм и выводят уже накопленный металл. Необходим пожизненный постоянный прием препаратов и постоянное динамическое наблюдение у врача для своевременной коррекции дозировки. Важно, как можно раньше начать лечение и использовать схему с постепенным увеличением дозы препарата. Кроме того, необходимо соблюдение специальной диеты, применение гепатопротекторной терапии, постоянный мониторинг функций печени, почек, состояния крови и др.
В Научном центре неврологии проводится комплексная диагностика, лечение и динамическое наблюдение пациентов с болезнью Вильсона-Коновалова. Наши специалисты назначат анализы, необходимые для подтверждения диагноза, расскажут о заболевании, подберут необходимую терапию. На базе ДНК-лаборатории проводится диагностика наиболее частых мутаций гена АТР7В, а в лаборатории нашего Центра проводят все необходимые анализы крови и мочи.
Клинико-генетическая характеристика пациентов с синдромом Питта–Хопкинса
Полный текст
Аннотация
Введение. Синдром Питта–Хопкинса (СПХ) — редкое наследственное заболевание, характеризующееся грубой задержкой моторного развития, умственной отсталостью, аутистическими чертами, эпизодами гипервентиляции с последующим апноэ, эпилепсией и фенотипическими особенностями. Причинами СПХ является микроделеция длинного плеча 18 хромосомы или точковая мутация гена TCF4. Спектр мутаций представлен в 40% случаев точковыми мутациями, в 30% — мелкими делециями/инсерциями, в 30% —крупными делециями. В настоящее время в мире описано более 500 случаев СПХ.
Материалы и методы. В исследование были включены 4 мальчика и 5 девочек с СПХ в возрасте от 1 года 8 месяцев до 12 лет. Диагноз был подтвержден с помощью хромосомного микроматричного анализа или секвенирования нового поколения.
Результаты. У 5 пациентов выявлены микроделеции длинного плеча 18 хромосомы. Размер выявленных микроделеций варьировал от 307 Kb до 11.62 Mb. Точковые мутации обнаружены у 4 детей: 2 пациентов имели мутацию в сайте сплайсинга, 1 — миссенс- и 1 — нонсенс-мутацию. Клиническая картина была проанализирована у всех детей: отмечались грубая задержка моторного и психоречевого развития, мышечная гипотония и специфические стигмы дизэмбриогенеза.
Заключение. При сравнительном анализе клинической картины у больных с СПХ, обусловленной микроделецией длинного плеча 18-й хромосомы и точковой мутацией гена TCF4, значимых различий не выявлено. Основными клиническими критериями, позволяющими заподозрить СПХ, являются грубая задержка развития, специфические особенности фенотипа, нарушения поведения и эпизоды гипервентиляции с последующим апноэ.
Ключевые слова
Полный текст
Введение
Синдром Питта–Хопкинса (СПХ) (OMIM 610954) — редкое наследственное заболевание, характеризующееся грубой задержкой моторного развития, умственной отсталостью, аутистическими чертами, эпизодами гипервентиляции с последующим апноэ, эпилепсией и фенотипическими особенностями [1–3]. Тип наследования аутосомно-доминантный. СПХ обусловлен гаплонедостаточностью транскрипционного фактора 4, т.е. потерей функции 1 из 2 клеточных копий гена TCF4 [2–4].
СПХ впервые описали в 1978 г. педиатр Дэвид Питт и детский невролог Ян Хопкинс в Королевском детском госпитале в Мельбурне. Они сообщили о 2 неродственных детях с тяжелой умственной отсталостью, эпизодами гипервентиляции с последующим апноэ и цианозом при просыпании, а также схожими фенотипическими особенностями [5].
В 2007 г. с помощью методов молекулярного кариотипирования было установлено, что причиной СПХ является микроделеция длинного плеча 18 хромосомы (18q21.2). Позже точковые мутации гена TCF4 также были описаны как этиологическая причина этого заболевания [3]. По данным литературы, спектр мутаций представлен в 40% случаев точковыми мутациями, в 30% — мелкими делециями/инсерциями и в 30% — крупными делециями [15]. Описано более 500 случаев СПХ [6]. Точная частота СПХ неизвестна, но предполагаемая популяционная частота, на основании проведенного хромосомного микроматричного анализа, составляет 1 : 34 000–1 : 41 000 [7].
Белок TCF4 является транскрипционным фактором, функция которого заключается в регуляции генной экспрессии. Многие из подобных регуляторных белков, принадлежащих к суперсемейству димеризующихся факторов транскрипции, имеют базовый структурный мотив спираль–петля–спираль (bHLH). Этот мотив способен взаимодействовать с ДНК и входит в состав многих белков регулирующих экспрессию генов. Показано, что у эмбриона TCF4 экспрессируется в мозге, сетчатке и внутренних органах, а у взрослых — в мозге, лимфоцитах, фибробластах, кишечнике, мышцах и мезенхимальных сплетениях [1, 3, 4, 8, 9].
Для больных с СПХ характерны грубая задержка моторного и психического развития, часто заметные уже на 1-м году жизни. Большинство пациентов с СПХ не могут самостоятельно ходить и не разговаривают. Для всех больных характерна мышечная гипотония, у многих встречается микроцефалия. Почти 40% пациентов имеют судороги, которые представлены генерализованными тонико-клоническими, aтоническими или фокальными приступами. Не существует специфических паттернов ЭЭГ, ассоциированных с этим синдромом, и противоэпилептических препаратов, более эффективных при СПХ по сравнению с другими заболеваниями. Около половины пациентов имеет пароксизмальные нарушения дыхания с гипервентиляцией с/без последующего апноэ, возникающих в возрасте 3–7 лет. Эти эпизоды описываются как быстрое тяжелое дыхание со следующим за ним остановкой, продолжающейся вплоть до выраженного цианоза и даже потери сознания [2, 10].
Другими проявлениями СПХ являются миопия, которая отмечается более чем у половины больных, и косоглазие. Характерным симптомом являются запоры, выявляемые у 40–65% пациентов, нередко начинающиеся с младенчества и часто очень тяжелые. Описаны случаи болезни Гиршпрунга и незавершенный поворот кишечника [2, 6, 10].
У больных с СПХ грубые черты лица с выступающей нижней частью, крючковатый нос, диспластичные ушные раковины, верхняя губа в виде «лука купидона» [2, 6, 10, 11]. Для больных с СПХ не характерны грубые пороки центральной нервной системы, описаны дисплазия мозолистого тела, уменьшение гиппокампа, гиперинтенсивность белого вещества височных долей, задержка миелинизации, гипоплазия червя мозжечка, атрофия мозжечка, вентрикуломегалия [6, 10].
Кроме СПХ описаны два заболевания со схожей клинической картиной и аутосомно-рецессивным типом наследования, которые называются Питт–Хопкинс-подобные синдромы, тип 1 и тип 2. Они обусловлены мутациями в генах CNTNAP2 (OMIM 610042) и NRXN1 (OMIM 614325). Эти заболевания, как и СПХ, характеризуются грубой задержкой развития, умственной отсталостью, судорогами, фенотипическими особенностями, но, как правило, больные имеют менее выраженную задержку в моторном развитии [12, 13].
Материал и методы
Мы проанализировали клиническую картину у 4 мальчиков и 5 девочек с СПХ. Возраст детей, включенных в исследование, варьировал от 1 года 8 мес до 12 лет, в среднем составляя 7 лет. Все пациенты были обследованы с помощью молекулярно-генетических методов. У 5 пациентов СПХ был диагностирован с помощью метода сравнительной геномной гибридизации, у 4 пациентов — методом высокопроизводительного секвенирования. Каждому пациенту был присвоен порядковый номер при проведении генетического исследования, под которым в дальнейшем он был включен в анализ клинических данных.
Результаты
Пациенты были направлены на медико-генетическую консультацию со следующими диагнозами: перинатальное поражение центральной нервной системы; задержка психомоторного развития; задержка/нарушение психоречевого развития (в том числе синдромального генеза); микроцефалия; множественные врожденные аномалии; детский церебральный паралич, гипотонически-астатическая и спастическая формы; синдром Ретта; синдром Ди Джорджи. Возраст пациентов на момент постановки диагноза варьировал от 2,5 мес до 9 лет и в среднем составил 3 года 1 мес.
При проведении микроматричного хромосомного анализа у 5 пациентов были выявлены микроделеции длинного плеча 18 хромосомы (табл. 1). Размер выявленных микроделеций варьировал от 307 кб до 11,62 Мб, составляя в среднем 5,226 Мб. Причем у одного ребенка делеция захватывала только начало гена TCF4, а у 4 детей весь ген TCF4 попал в зону делеции. Точковые мутации обнаружены у 4 детей с помощью панели «Умственная отсталость и расстройства аутистического спектра», клинического или полноэкзомного секвенирования: 2 пациентов имели мутацию в сайте сплайсинга, 1 миссенс- и 1 нонсенс-мутацию.
Таблица 1. Результаты молекулярно-генетического исследования у пациентов с СПХ
Table 1. The results of molecular genetic studies in patients with PHS