Распад крови что это
Что такое гемолитическая болезнь (ГБН)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Руденко А. А., неонатолога со стажем в 5 лет.
Определение болезни. Причины заболевания
Гемолитическая болезнь новорождённого (ГБН) — это заболевание, при котором эритроциты новорождённого разрушаются антителами матери. Это происходит из-за несовместимости крови матери и ребёнка по антигенам эритроцитов (красных кровяных клеток), чаще всего по резус-фактору и системе групп крови, реже по другим факторам крови.
Чтобы разобраться, что такое гемолитическая болезнь, необходимо понимать значение некоторых терминов:
Известно более 250 эритроцитарных антигенов, которые образуют более 20 антигенных систем. Однако наиболее важное клиническое значение имеют антигены резус-фактора (Rh) и системы групп крови (АВ0).
Система резус-фактора
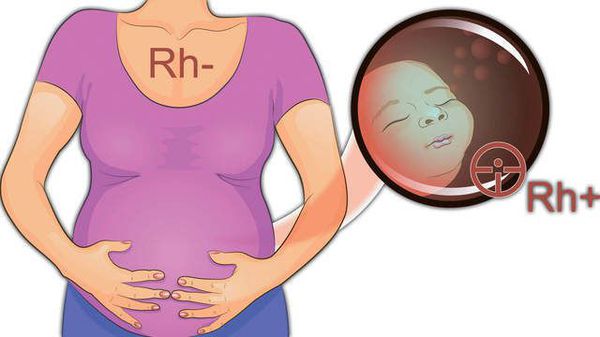
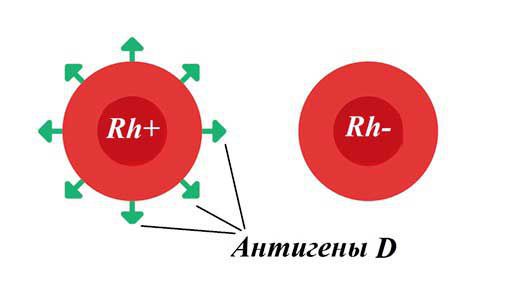
Резус-фактор — белок, который может содержаться на поверхности эритроцитов . Кровь считается резус-положительной (Rh+), если на красных кровяных клетках человека есть резус-фактор (антиген D). Если этого антигена на эритроцитах нет, то кровь является резус-отрицательной (Rh-). У большинства людей кровь резус-положительная.
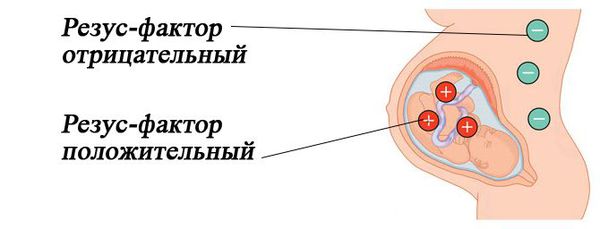
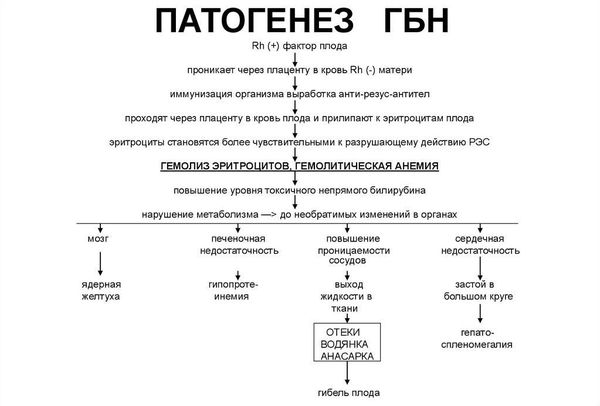
Резус-несовместимость возникает тогда, когда у матери резус-отрицательная кровь, а у ребёнка резус-положительная. В этом случае иммунная система матери может распознавать эритроциты плода как «инородные» и потенциально опасные и вырабатывать антитела против резус-фактора на эритроцитах плода. Антитела прикрепляются к эритроцитам ребёнка и разрушают их (происходит гемолиз). Этот процесс начинается в период его внутриутробного развития и продолжается после рождения. Если плод имеет резус-отрицательную кровь, а мама резус-положительную, конфликта не возникает.
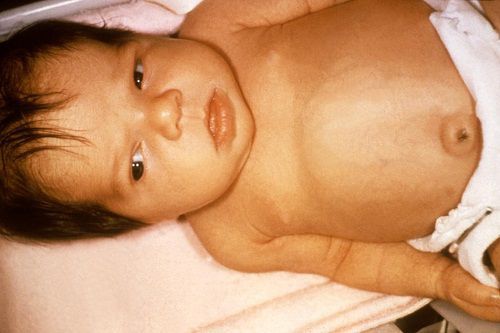
Основными проявлениями ГБН является ранняя желтуха и анемия новорождённого.
Система групп крови
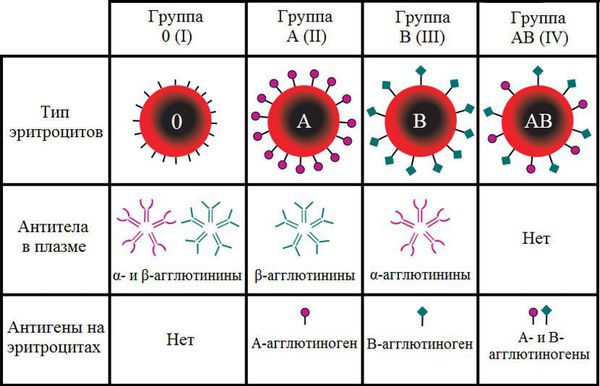
Группа крови — это определённое сочетание врождённых антигенов на поверхности эритроцитов и антител в плазме крови. Двумя основными антигенами эритроцитов являются А и В. Группы крови определяются на основании наличия или отсутствия этих антигенов. Одноимённые антитела обозначаются греческими буквами α и β.
Кровь любого человека может одновременно содержать только противоположные антигены и антитела или не иметь каких-то из них. В противном случае должна произойти агглютинация (склеивание) клеток крови. Этот процесс может привести к летальному исходу из-за формирования тромбов и закупорки кровеносных сосудов.
В зависимости от сочетания антигенов и антител различают четыре группы крови по системе АВ0.
Группы риска по развитию данной патологии:
Симптомы гемолитической болезни
Во время беременности признаки несовместимости крови матери и плода не проявляются.
Клиническая картина гемолитической болезни новорождённых зависит от проявления одной из трёх форм: анемической, желтушной и отёчной. Но может иметь место сочетание клинических форм.
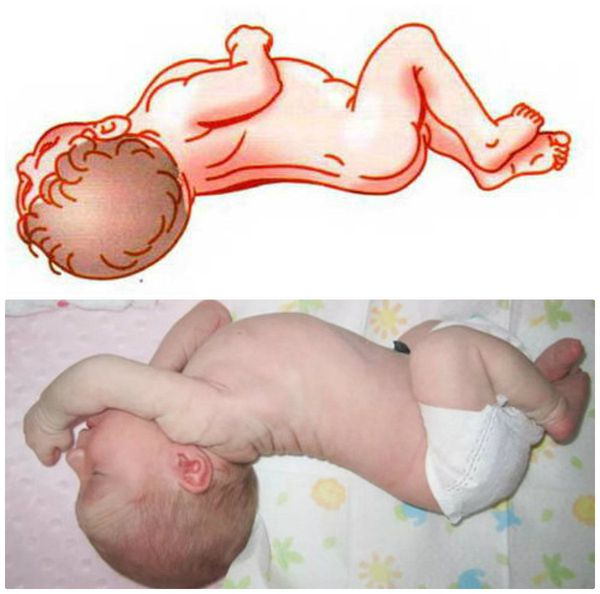
1. Анемическая форма ГБН. Является наиболее лёгкой формой и проявляется бледностью кожных покровов, неврологическими нарушениями (вялость: ребёнок неохотно сосёт грудь, много спит) и признаками увеличения печени и селезёнки, которые наблюдаются в динамике.
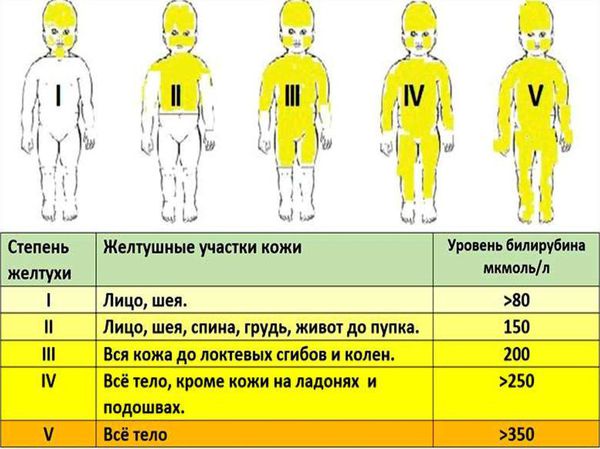
Интенсивность желтухи будет зависеть от уровня билирубина ( жёлчного пигмента, который образуется при разрушении эритроцитов ). Именно билирубин окрашивает кожу в жёлтый цвет. При достижении критических цифр этот фермент может поражать нейроны головного мозга, что приводит к повреждению его структур и развитию грозного осложнения — билирубиновой энцефалопатии (ядерной желтухи).
Кожа и видимые слизистые новорождённого бледно-розовые, могут иметь слегка желтоватый оттенок, печень и селезёнка увеличены — всё это обусловлено повышенным распадом эритроцитов, что приводит к анемии. Дети с такой формой заболевания нуждаются в интенсивном лечении, включающем в себя операцию заменного переливания крови (ОЗПК).
Патогенез гемолитической болезни
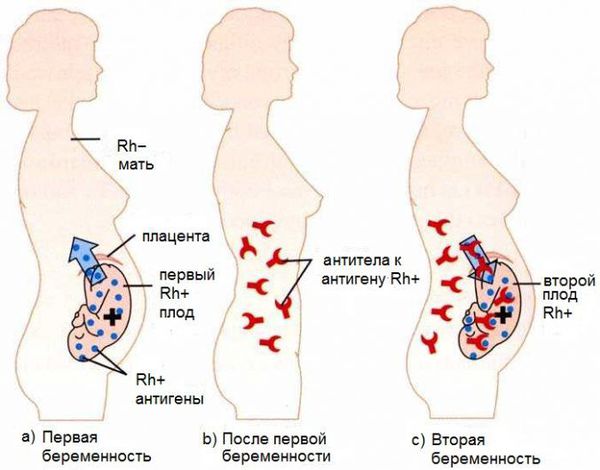
Развитие гемолитической болезни возможно лишь при контакте крови матери и плода. Во время беременности благодаря плаценте эритроциты плода попадают в организм матери в незначительном количестве, недостаточном для выработки антител. В момент родоразрешения, вследствие абортов, выкидышей или осложнённых беременностей эритроциты проникают в кровоток матери в большом количестве, что вызывает выработку антител класса М (IgM). Эти антитела образуются почти сразу после контакта с резус-положительной кровью плода. Они обеспечивают временный иммунитет от любых чужеродных веществ, однако IgM не способны проникать через плаценту к ребёнку.
Антитела класса М затем трансформируются в антитела класса G (IgG). Они вырабатываются через 3 месяца после контакта с резус-положительными эритроцитами, обеспечивают длительный иммунитет в течение нескольких лет и способны пройти через плаценту в кровь плода. Этим объясняется тот факт, что при первой беременности эти иммунные частицы для плода не опасны, ведь при нормально протекающей беременности кровь ребёнка смешивается с кровью матери лишь на последних месяцах беременности или после родов, когда IgG ещё не выработались.
При первой беременности происходит лишь узнавание эритроцитов плода, т. е. первичный иммунный ответ, который ещё называют «раздражением» иммунной системы матери. Также для этого процесса используется термин «сенсибилизация», а применимо к резус-конфликту — «резус-сенсибилизация». Первичный иммунный ответ не опасен для плода.
Как правило, конфликт по резус-фактору развивается при повторной беременности. Это связано с тем, что к моменту следующего зачатия в организме матери уже присутствуют антитела класса G, поэтому они начинают атаковать эритроциты плода уже на ранних сроках. В связи с этим вероятность развития данного заболевания, как и тяжесть, растёт с каждой последующей беременностью. Болезнь встречается у 63 % детей от женщин с сенсибилизацией.
Продуктом распада эритроцитов является непрямой билирубин — желчный пигмент. Билирубин является токсичным ферментом, который повреждает ткани головного мозга, печени, лёгких, почек и т. д. Критическое повышение уровня непрямого билирубина приводит к необратимому повреждению структур головного мозга — билирубиновой энцефалопатии (ядерной желтухе).
Классификация и стадии развития гемолитической болезни
Классификация по ведущим клиническим проявлениям:
По наличию или отсутствию осложнений:
По степени тяжести:
Осложнения гемолитической болезни
Диагностика гемолитической болезни
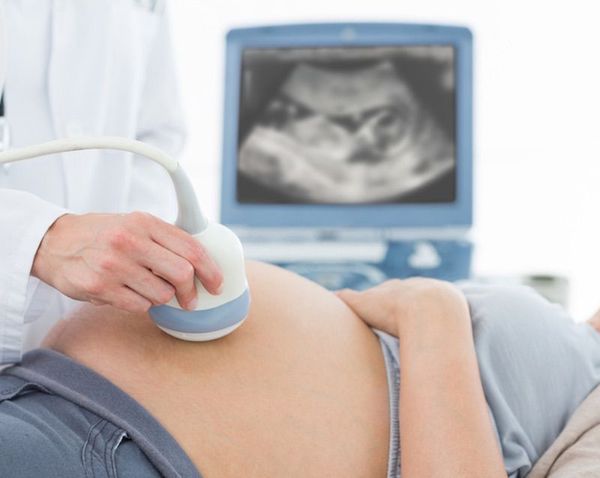
Диагноз ГБН может быть заподозрен ещё внутриутробно: на основании анамнеза, данных УЗИ и лабораторных данных.
Неинвазивным методом диагностики гемолитической болезни является УЗИ плода. При данном исследовании уже внутриутробно можно заподозрить отёчную форму ГБН.
В палате совместного пребывания мама может сама обратить внимание на желтушность кожных покровов, видимых слизистых и склер в первые сутки, а иногда и часы жизни, желтуха будет прогрессировать. Также можно заметить бледность кожи и слизистых.
При подозрении на ГБН неонатолог проводит целый ряд лабораторных исследований, чтобы подтвердить заболевание и определить его форму:
Гемолитическую болезнь новорождённых необходимо отличать от других заболеваний:
Лечение гемолитической болезни
Основные критерии выбора тактики лечения: форма гемолитической болезни новорождённых, тяжесть анемии, уровень билирубина и его почасовой прирост.
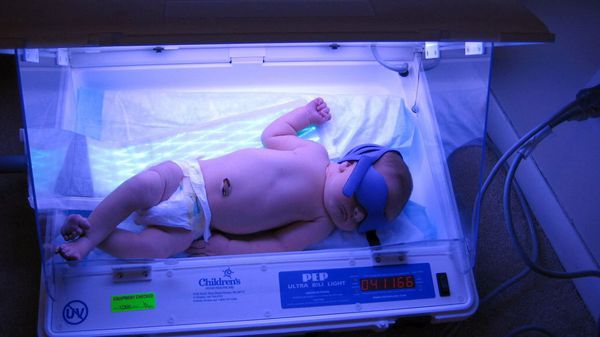
С первых часов постановки диагноза фототерапия должна проводиться в непрерывном режиме. При этом источник света должен находиться от ребёнка на расстоянии не более 50 см. Во время процедуры кожа новорождённого должна быть максимально открытой: предпочтительно оставлять ребёнка в одном подгузнике, а глаза закрывать светонепроницаемыми очками.
Побочные эффекты данного вида лечения:
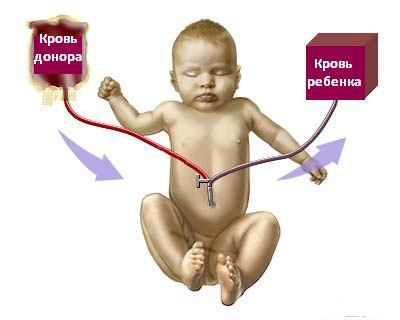
Обменное переливание крови проводится через стерильный катетер, введённый в вену пуповины. Суть операции заключается в медленном дробном выведении крови из организма новорождённого с последующим попеременным замещением эритроцитарной массой и плазмой донора в равном количестве.
При проведении ОЗПК возможно развитие осложнений: гематологических, инфекционных, метаболических, системных и осложнений со стороны сердечно-сосудистой системы.
Прогноз. Профилактика
Профилактика данного заболевания может быть специфической и неспецифической.
Прогноз. Более 90 % детей, получивших своевременное лечение, впоследствии не имеют неврологических нарушений.
Распад крови что это
Анализ, в ходе которого определяется содержание в крови желчных пигментов и их фракций. Они являются метаболитами распада гемоглобина, и их уровень повышается при усиленном разрушении эритроцитов, нарушении функции печени и желчевыводящих путей.
Результаты исследований выдаются с бесплатным комментарием врача.
Колориметрический фотометрический метод.
Мкмоль/л (микромоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Билирубин – желтый пигмент, который является компонентом желчи и образуется в селезенке и костном мозге при распаде эритроцитов. В норме эритроциты разрушаются через 110-120 дней после выхода из костного мозга. При этом из погибших клеток высвобождается металлопротеин гемоглобин, состоящий из железосодержащей части – гема и белкового компонента – глобина. От гема отщепляется железо, которое повторно используется в качестве необходимого компонента ферментов и других белковых структур, а гемовые белки превращаются в билирубин. Непрямой (неконъюгированный) билирубин с помощью альбуминов доставляется кровью в печень, где благодаря ферменту глюкуронилтрансферазе соединяется с глюкуроновой кислотой и образует прямой (конъюгированный) билирубин. Процесс превращения водонерастворимого билирубина в водорастворимый называется конъюгацией. Связанная фракция пигмента практически не поступает в кровь и в норме экскретируется с желчью. Билирубин в просвете кишечника под действием бактерий кишечника метаболизируется и выводится с калом, придавая ему темную окраску.
Прямой билирубин назван так в связи с методикой лабораторного исследования. Данный водорастворимый пигмент непосредственно взаимодействует с реактивами (диазореактивом Эрлиха), добавленными в пробу крови. Неконъюгированный (непрямой, свободный) билирубин нерастворим в воде, и для его определения необходимы дополнительные реактивы.
В норме за сутки в человеческом организме вырабатывается 250-350 мг билирубина. Выработка более 30-35 мкмоль/л проявляется желтушностью кожных покровов и склер. По механизму развития желтухи и преобладанию фракций билирубина в крови выделяют надпеченочную (гемолитическую), печеночную (паренхиматозную) или подпеченочную (механическую, обтурационную) желтуху.
При повышенном разрушении эритроцитов (гемолизе) или нарушенном захвате печенью желчного пигмента увеличивается содержание билирубина за счет неконъюгированной фракции без повышения уровня связанного пигмента (надпеченочная желтуха). Данная клиническая ситуация наблюдается при некоторых врождённых состояниях, связанных с нарушением конъюгации билирубина, например при синдроме Жильбера.
При наличии преграды на пути выхода желчи в двенадцатиперстную кишку или нарушениях желчевыделения в крови повышается прямой билирубин, что нередко является признаком обтурационной (механической) желтухи. При обструкции желчевыводящих путей прямой билирубин попадает в кровь, а затем и в мочу. Он является единственной фракцией билирубина, способной выделяться почками и окрашивать мочу в темный цвет.
Увеличение билирубина за счет прямой и непрямой фракции указывает на заболевание печени с нарушением захвата и выделения желчных пигментов.
Повышение непрямого билирубина нередко наблюдается у новорождённых в первые 3 дня жизни. Физиологическая желтуха связана с повышенным распадом эритроцитов с фетальным гемоглобином и недостаточной зрелостью ферментных систем печени. При затянувшейся желтухе у новорождённых необходимо исключать гемолитическую болезнь и врождённую патологию печени и желчевыводящих путей. При конфликте групп крови матери и ребенка возникает повышенный распад эритроцитов малыша, что приводит к повышению непрямого билирубина. Неконъюгированный билирубин обладает токсическим действием на клетки нервной системы и может привести к повреждению головного мозга новорождённого. Гемолитическая болезнь новорождённых требует немедленного лечения.
У 1 из 10 тысяч младенцев выявляется атрезия желчевыводящих путей. Данная угрожающая жизни ребенка патология сопровождается повышением билирубина за счет прямой фракции и требует срочного хирургического вмешательства и в некоторых случаях трансплантации печени. У новорождённых также существует вероятность наличия гепатита с повышением как прямого, так и непрямого билирубина.
Изменения уровня фракций билирубина в крови с учетом клинической картины позволяют оценить возможные причины желтухи и определиться с дальнейшей тактикой обследования и лечения.
Для чего используется исследование?
Когда назначается анализ?
Что такое гемолиз?
Гемолиз
Что такое гемолиз? Гемолиз, как лабораторное понятие, — это разрушение эритроцитов («красных кровяных клеток») в образце крови, с выходом из них различных биологически активных веществ и, что самое главное, гемоглобина в плазму.
Почему происходит гемолиз? Гемолиз чаще всего обусловлен физиологическими особенностями организма человека, сдавшего кровь, а также нарушением методики забора крови.
Причины, связанные с методикой забора крови, приводящие к гемолизу:
Следует также отметить, что в образцах капиллярной крови гемолиз возникает в два раза чаще. В связи с этим рекомендуется для выполнения всех лабораторных исследований использовать венозную кровь.
Почему по гемолизированной крови выполнить анализ, зачастую, невозможно?
Выполнению анализа «мешают» те вещества, которые выходят в плазму из эритроцитов. Главным образом — это гемоглобин. При выполнении многих тестов приборы для их проведения могут неправильно интерпретировать полученный результат и выдать неправильный результат.
Как выявить гемолиз образца крови? Основным признаком гемолиза крови служит изменение ее окраски (см. рисунок). Степень изменения окраски напрямую соответствует степени гемолиза. Однако слабый гемолиз не всегда может быть заметен визуально. Поэтому в нашей лаборатории все образцы крови, подозрительные на гемолиз, подвергаются специальному исследованию, которое позволяет оценить примерное количество свободного гемоглобина в крови, а, следовательно, точно определить степень гемолиза.
Медицинской сестре следует всегда обращать внимание на окраску сыворотки после взятия крови. В случае если образец крови имеет признаки гемолиза, его лучше не отправлять в лабораторию, так как есть вероятность того, что выполнить исследования по такой крови не удастся. В этом случае необходимо взять кровь на анализ повторно.
Как избежать гемолиза в образцах крови? Для этого необходимо строго следовать правилам взятия крови и четко и аккуратно выполнять все необходимые преаналитические действия с полученным образцом.
Вот основные правила, которым необходимо следовать в процессе взятия крови:
Публикации в СМИ
Анемия гемолитическая
Гемолитические анемии — большая группа анемий, характеризующихся снижением средней продолжительности жизни эритроцитов (в норме 120 дней). Гемолиз (разрушение эритроцита) может быть внесосудистым (в селезёнке, печени или костном мозге) и внутрисосудистым. Общие признаки — выраженная интоксикация с ознобом и лихорадкой, боли в пояснице и животе, возможен шок в результате нарушения микроциркуляции, желтуха, спленомегалия, гемоглобинурия.
Этиология. Гемолитические анемии возникают при дефектах эритроцитов (внутриклеточные факторы) либо под воздействием внешних по отношению к эритроцитам причин (внеклеточные факторы). Обычно внутриклеточные факторы — наследуемые, а внеклеточные — приобретённые.
• Внеклеточные факторы. Микроокружение эритроцитов представлено плазмой и эндотелием сосудов. Присутствие в плазме токсических веществ или инфекционных агентов вызывает изменения стенки эритроцита, что приводит к: (1) выработке аутоантител к изменённому эритроциту (классический пример — аутоиммунная гемолитическая анемия), (2) непосредственному разрушению эритроцита •• Изоиммунные гемолитические анемии наблюдают при эритробластозе плода; сюда также можно отнести гемолитические трансфузионные реакции •• Дефекты эндотелия сосудов (микроангиопатии) также способны повреждать эритроциты — анемия гемолитическая микроангиопатическая. У детей может протекать остро в виде гемолитико-уремического синдрома •• Гемоглобинурия пароксизмальная холодовая •• Назначение некоторых ЛС (например, сульфаниламидов, противомалярийных препаратов) приводит к гемолитическому кризу.
• Внутриклеточные факторы. Внутриклеточные дефекты включают аномалии мембран эритроцитов, Hb или ферментов. Эти дефекты наследуемы (исключая пароксизмальную ночную гемоглобинурию) •• Дефекты мембран ••• Сфероцитоз наследуемый ••• Эллиптоцитоз наследуемый ••• Гемоглобинурия пароксизмальная ночная •• Гемоглобинопатии (например, серповидноклеточная анемия). Известно более 300 заболеваний, обусловленных точечными мутациями генов глобинов. Дефект молекулы глобина способствует нарушению его полимеризации. Изменяются мембрана, форма эритроцита, увеличивается подверженность гемолизу •• Энзимопатии.
Некоторые гемолитические анемии, обусловленные недостаточностью ферментов
• Анемия вследствие недостаточности глюкозо-6-фосфатдегидрогеназы (Г-6-ФД, см. также приложение к этой статье). Клиническая картина: острые эпизоды гемолитической анемии, обычно провоцируемые ЛС, инфекциями (также при желтухе новорождённых и фавизме). Лечение • Заместительная терапия (гемотрансфузии) • Спленэктомия при недостаточности Г-6-ФД бесполезна • Пациенты с вариантами недостаточности Г-6-ФД, связанными с острыми гемолитическими кризами, должны избегать приёма ЛС, вызывающих гемолиз. МКБ-10 D55.0 Анемия вследствие недостаточности Г-6-ФД.
МКБ-10 • D55 Анемия вследствие ферментных нарушений • D56 Талассемия • D57 Серповидноклеточные нарушения • D58 Другие наследственные гемолитические анемии • D59 Приобретённая гемолитическая анемия
ПРИЛОЖЕНИЯ
Фавизм (примахиновая анемия) — острое состояние, возникающее при употреблении в пищу некоторых видов бобовых (например, конских бобов Vicia fava), в результате ингаляции пыльцы их цветов, а также после приёма некоторых ЛС (примахин, сульфаниламиды, салицилаты, нитрофураны, производные витамина К и др.). Встречается повсеместно, но чаще в районах, эндемичных по малярии. Возможен у части лиц с наследственной недостаточностью Г-6-ФД (305900, ген G6PD, Xq28). Клиническая картина: высокая температура тела, головная боль, боли в животе, гемолитическая анемия, эозинофилия, желтуха, диарея, рвота, упадок сил и кома. Лечение поддерживающее • гемотрансфузии • фолиевая кислота • поддержание адекватного диуреза • алкалинизация мочи. МКБ-10. D55.0 Анемия вследствие недостаточности глюкозо-6-фосфатдегидрогеназы. Фавизм.
Гемоглобинурия пароксизмальная ночная — хроническое заболевание с эпизодами гемолитической анемии и гемоглобинурией (преимущественно по ночам). Характерны желтушность кожи или её бронзовая окраска, умеренное увеличение селезёнки, иногда — печени, макроцитоз, анизоцитоз. Наблюдают редко (2/1 млн населения). Предрасположенность к развитию заболеванию (*311770, Xq22.1, ген PIGA, À ). Диагностика: эпизоды утренней чёрной мочи, при добавлении столового сахара к крови больного происходит гемолиз. Лечение. ГК (например, преднизолон 20–40 мг/сут) вызывают стойкую ремиссию у 50% пациентов. Не рекомендуют переливать плазму, но отмытую эритроцитарную массу можно переливать во время кризов. Гепарин следует применять с осторожностью, т.к. возможно усиление гемолиза. Препараты железа внутрь. Синонимы: синдром Маркиафавы–Микели, болезнь Маркиафавы–Микели. МКБ-10. D59.5 Пароксизмальная ночная гемоглобинурия. Холодовая — редкое заболевание, характеризующееся возникновением гемолиза после холодового воздействия (атмосферный воздух, холодная вода). Обычно возникает после перенесённой вирусной инфекции. Гемолиз индуцируется фиксированными на эритроцитах гемолизинами Доната–Ландштайнера. Течение может быть острым, прогрессирующим или рецидивирующим. Синонимы: анемия гемолитическая Доната–Ландштайнера, синдром Дресслера, синдром Гарли. МКБ-10. D59.6 Гемоглобинурия вследствие гемолиза, вызванного другими внешними причинами.
Стоматоцитоз • I (#185020, 9q34.1, ген EPB72 [133090], Â ), мутация гена стоматина (внутренний белок мембран эритроцитов). Клинически: гемолитическая анемия, стоматоцитоз. Лабораторно: укорочение времени циркуляции эритроцитов, их увеличенная осмотическая резистентность, увеличение содержания внутриклеточного содержания ионов натрия • Стоматоцитоз II (*185010, Â ). Клинически: гемолитическая анемия, стоматоцитоз, холелитиаз, периодическая желтуха. Лабораторно: уменьшенная осмотическая резистентность эритроцитов, увеличение внутриклеточного натрия • Стоматоцитоз холодочувствительный (185020, Â ). Клинически: гемолитическая анемия, стоматоцитоз. Лабораторно: Усиление аутогемолиза и увеличение осмотической резистентности эритроцитов при 5 °C, холодовой гемолиз, предотвращаемый уменьшением pH или увеличением содержания АТФ.
Недостаточность альдолазы. Фруктозо-1,6-дифосфат альдолаза (триозофосфатлиаза, КФ 4.1.2.13, 3 изофермента: альдолазы 1, 2 и 3, или А, B и C) — гликолитический фермент, катализирующий обратимое превращение фруктозо-1,6-дифосфата в глицеральдегид 3-фосфат и дигидроксиацетон фосфат. Альдолаза A экспрессируется в тканях плода и в скелетных мышцах (5% от всего мышечного белка), альдолаза В — в печени, почках, кишечнике, альдолазы A и C — в нервной ткани. Известны наследственные заболевания, развивающиеся вследствие недостаточности разных альдолаз. Альдолаза А (103850, 16q22–q24, ген ALDOА, r ). При недостаточности фермента развивается врождённая несфероцитарная гемолитическая анемия (желтуха, спленомегалия, холелитиаз, возможны низкорослость, задержка умственного развития и полового созревания). Альдолаза В (229600, 9q22, ген ALDOВ, r ). При мутациях гена развивается врождённая непереносимость фруктозы (фруктоземия). Клинически: вялость сосания, задержка роста и развития, гипогликемия, метаболический ацидоз, рвота, гепатомегалия, цирроз печени, желудочно-кишечные кровотечения, судорожные припадки, проксимальный канальцевый ацидоз. Лабораторно: фруктоземия, гипербилирубинемия, гиперурикемия, глюкозурия, гипофосфатемия и фосфатурия, высокие значения pH мочи. МКБ-10. D55.2 Анемия вследствие нарушений гликолитических ферментов.
Код вставки на сайт
Анемия гемолитическая
Гемолитические анемии — большая группа анемий, характеризующихся снижением средней продолжительности жизни эритроцитов (в норме 120 дней). Гемолиз (разрушение эритроцита) может быть внесосудистым (в селезёнке, печени или костном мозге) и внутрисосудистым. Общие признаки — выраженная интоксикация с ознобом и лихорадкой, боли в пояснице и животе, возможен шок в результате нарушения микроциркуляции, желтуха, спленомегалия, гемоглобинурия.
Этиология. Гемолитические анемии возникают при дефектах эритроцитов (внутриклеточные факторы) либо под воздействием внешних по отношению к эритроцитам причин (внеклеточные факторы). Обычно внутриклеточные факторы — наследуемые, а внеклеточные — приобретённые.
• Внеклеточные факторы. Микроокружение эритроцитов представлено плазмой и эндотелием сосудов. Присутствие в плазме токсических веществ или инфекционных агентов вызывает изменения стенки эритроцита, что приводит к: (1) выработке аутоантител к изменённому эритроциту (классический пример — аутоиммунная гемолитическая анемия), (2) непосредственному разрушению эритроцита •• Изоиммунные гемолитические анемии наблюдают при эритробластозе плода; сюда также можно отнести гемолитические трансфузионные реакции •• Дефекты эндотелия сосудов (микроангиопатии) также способны повреждать эритроциты — анемия гемолитическая микроангиопатическая. У детей может протекать остро в виде гемолитико-уремического синдрома •• Гемоглобинурия пароксизмальная холодовая •• Назначение некоторых ЛС (например, сульфаниламидов, противомалярийных препаратов) приводит к гемолитическому кризу.
• Внутриклеточные факторы. Внутриклеточные дефекты включают аномалии мембран эритроцитов, Hb или ферментов. Эти дефекты наследуемы (исключая пароксизмальную ночную гемоглобинурию) •• Дефекты мембран ••• Сфероцитоз наследуемый ••• Эллиптоцитоз наследуемый ••• Гемоглобинурия пароксизмальная ночная •• Гемоглобинопатии (например, серповидноклеточная анемия). Известно более 300 заболеваний, обусловленных точечными мутациями генов глобинов. Дефект молекулы глобина способствует нарушению его полимеризации. Изменяются мембрана, форма эритроцита, увеличивается подверженность гемолизу •• Энзимопатии.
Некоторые гемолитические анемии, обусловленные недостаточностью ферментов
• Анемия вследствие недостаточности глюкозо-6-фосфатдегидрогеназы (Г-6-ФД, см. также приложение к этой статье). Клиническая картина: острые эпизоды гемолитической анемии, обычно провоцируемые ЛС, инфекциями (также при желтухе новорождённых и фавизме). Лечение • Заместительная терапия (гемотрансфузии) • Спленэктомия при недостаточности Г-6-ФД бесполезна • Пациенты с вариантами недостаточности Г-6-ФД, связанными с острыми гемолитическими кризами, должны избегать приёма ЛС, вызывающих гемолиз. МКБ-10 D55.0 Анемия вследствие недостаточности Г-6-ФД.
МКБ-10 • D55 Анемия вследствие ферментных нарушений • D56 Талассемия • D57 Серповидноклеточные нарушения • D58 Другие наследственные гемолитические анемии • D59 Приобретённая гемолитическая анемия
ПРИЛОЖЕНИЯ
Фавизм (примахиновая анемия) — острое состояние, возникающее при употреблении в пищу некоторых видов бобовых (например, конских бобов Vicia fava), в результате ингаляции пыльцы их цветов, а также после приёма некоторых ЛС (примахин, сульфаниламиды, салицилаты, нитрофураны, производные витамина К и др.). Встречается повсеместно, но чаще в районах, эндемичных по малярии. Возможен у части лиц с наследственной недостаточностью Г-6-ФД (305900, ген G6PD, Xq28). Клиническая картина: высокая температура тела, головная боль, боли в животе, гемолитическая анемия, эозинофилия, желтуха, диарея, рвота, упадок сил и кома. Лечение поддерживающее • гемотрансфузии • фолиевая кислота • поддержание адекватного диуреза • алкалинизация мочи. МКБ-10. D55.0 Анемия вследствие недостаточности глюкозо-6-фосфатдегидрогеназы. Фавизм.
Гемоглобинурия пароксизмальная ночная — хроническое заболевание с эпизодами гемолитической анемии и гемоглобинурией (преимущественно по ночам). Характерны желтушность кожи или её бронзовая окраска, умеренное увеличение селезёнки, иногда — печени, макроцитоз, анизоцитоз. Наблюдают редко (2/1 млн населения). Предрасположенность к развитию заболеванию (*311770, Xq22.1, ген PIGA, À ). Диагностика: эпизоды утренней чёрной мочи, при добавлении столового сахара к крови больного происходит гемолиз. Лечение. ГК (например, преднизолон 20–40 мг/сут) вызывают стойкую ремиссию у 50% пациентов. Не рекомендуют переливать плазму, но отмытую эритроцитарную массу можно переливать во время кризов. Гепарин следует применять с осторожностью, т.к. возможно усиление гемолиза. Препараты железа внутрь. Синонимы: синдром Маркиафавы–Микели, болезнь Маркиафавы–Микели. МКБ-10. D59.5 Пароксизмальная ночная гемоглобинурия. Холодовая — редкое заболевание, характеризующееся возникновением гемолиза после холодового воздействия (атмосферный воздух, холодная вода). Обычно возникает после перенесённой вирусной инфекции. Гемолиз индуцируется фиксированными на эритроцитах гемолизинами Доната–Ландштайнера. Течение может быть острым, прогрессирующим или рецидивирующим. Синонимы: анемия гемолитическая Доната–Ландштайнера, синдром Дресслера, синдром Гарли. МКБ-10. D59.6 Гемоглобинурия вследствие гемолиза, вызванного другими внешними причинами.
Стоматоцитоз • I (#185020, 9q34.1, ген EPB72 [133090], Â ), мутация гена стоматина (внутренний белок мембран эритроцитов). Клинически: гемолитическая анемия, стоматоцитоз. Лабораторно: укорочение времени циркуляции эритроцитов, их увеличенная осмотическая резистентность, увеличение содержания внутриклеточного содержания ионов натрия • Стоматоцитоз II (*185010, Â ). Клинически: гемолитическая анемия, стоматоцитоз, холелитиаз, периодическая желтуха. Лабораторно: уменьшенная осмотическая резистентность эритроцитов, увеличение внутриклеточного натрия • Стоматоцитоз холодочувствительный (185020, Â ). Клинически: гемолитическая анемия, стоматоцитоз. Лабораторно: Усиление аутогемолиза и увеличение осмотической резистентности эритроцитов при 5 °C, холодовой гемолиз, предотвращаемый уменьшением pH или увеличением содержания АТФ.
Недостаточность альдолазы. Фруктозо-1,6-дифосфат альдолаза (триозофосфатлиаза, КФ 4.1.2.13, 3 изофермента: альдолазы 1, 2 и 3, или А, B и C) — гликолитический фермент, катализирующий обратимое превращение фруктозо-1,6-дифосфата в глицеральдегид 3-фосфат и дигидроксиацетон фосфат. Альдолаза A экспрессируется в тканях плода и в скелетных мышцах (5% от всего мышечного белка), альдолаза В — в печени, почках, кишечнике, альдолазы A и C — в нервной ткани. Известны наследственные заболевания, развивающиеся вследствие недостаточности разных альдолаз. Альдолаза А (103850, 16q22–q24, ген ALDOА, r ). При недостаточности фермента развивается врождённая несфероцитарная гемолитическая анемия (желтуха, спленомегалия, холелитиаз, возможны низкорослость, задержка умственного развития и полового созревания). Альдолаза В (229600, 9q22, ген ALDOВ, r ). При мутациях гена развивается врождённая непереносимость фруктозы (фруктоземия). Клинически: вялость сосания, задержка роста и развития, гипогликемия, метаболический ацидоз, рвота, гепатомегалия, цирроз печени, желудочно-кишечные кровотечения, судорожные припадки, проксимальный канальцевый ацидоз. Лабораторно: фруктоземия, гипербилирубинемия, гиперурикемия, глюкозурия, гипофосфатемия и фосфатурия, высокие значения pH мочи. МКБ-10. D55.2 Анемия вследствие нарушений гликолитических ферментов.