с чем реагирует уран
Химические свойства урана
Уран – чрезвычайно реакционно-способный металл!!
В ряду напряжений уран находится вблизи бериллия и алюминия и является сильным восстановителем.
На воздухе. Химическая активность урана в обычной атмосфере приводит к образованию плёнки на его поверхности даже при комнатной температуре. Цвет этой плёнки и её толщина меняются за время от нескольких часов до нескольких дней и недель от светло-жёлтого через коричневый и фиолетовый до синего и чёрного.
Развитие поверхности, естественно, увеличивает скорость окисления. Но! Оксиды плохо пассивируют металл.
До 100 о С – оксидная плёнка по составу примерно соответствует UO2. При 220-250 о С скорость окисления резко возрастает, появляются U4O9 и даже U3О8.
С азотом реакция взаимодействия начинается только при
800 о С (когда уран присутствует в виде γ-фазы) скорость азотирования резко возрастает. Образуется нитрид близкий к U2N3. Оксидные плёнки блокируют взаимодействие с азотом. Нитридные покрытия также не защищают металл от дальнейшей коррозии.
Вода и водяной пар:
Холодная вода на компактный уран не действует.
При кипении начинается медленное взаимодействие.
Выделяющийся водород ускоряет коррозию вследствие образования гидрида урана.
7 U + 6 H2O → 3 UO2 + 4 UH3↑ (t = 150-250 o C)
Водяной пар вызывает катастрофическую коррозию.
Разбавленная серная кислота (до 3 М) не реагирует с компактным металлом даже при температуре кипения. Действие этих растворов аналогично действию воды на уран. При нагревании более концентрированные растворы серной кислоты взаимодействуют с ураном с образованием нормального сульфата четырёхвалентного урана. Горячая концентрированная серная кислота взаимодействует с ураном с образование бисульфата урана и продуктов восстановления серной кислоты (серы, сероводорода и диоксида серы).
Чистый металл растворяется в азотной кислоте с умеренной скоростью и образует нитрат уранила.
Урановая стружка, спеченный или спрессованный порошок или другие образцы с большой поверхностью могут окисляться азотной кислотой со взрывом.
Уран исключительно быстро реагирует с 12 н. соляной кислотой. В 6 н. кислоте реакция идёт всё ещё быстро, но 2 н. кислота действует на металл медленно. Вскоре после начала растворения заметна простым глазом красно-фиолетовая окраска трёхвалентного урана:
U 3+ легко окисляется:
2 U 3+ + 2 H + + ½ O2 → 2 U 4+ + H2O
Однако во всех случаях остаётся нерастворимый чёрный остаток (оксиды урана). Для полного растворения необходимы добавки окислителей.
Разбавленная серная кислота слабо действует на уран, с повышением температуры действие усиливается. Среди продуктов реакции присутствуют S, H2S, SO2… С добавлением окислителей (азотная кислота или перекись водорода) происходит образование UO2SO4.
UF4 + 2 Al 3+ → 2 AlF2 + + U 4+
Сплавы урана обычно растворяются также легко, как металлический уран, а некоторые из них – ещё легче. Например, сплавы урана со свинцом или висмутом реагируют с водой.
Компактный металлический уран взаимодействует с водородом при 200-300 о С. Выше 440 о C уран с водородом не взаимодействует.
Гидрид урана используют в качестве промежуточного продукта для получения особо чистых соединений урана и для приготовления очень активного порошка металлического урана. UH3 обладает металлическими свойствами и его электропроводность мало отличается от электропроводности металлического урана. Гидрид урана является очень активным соединением, обладает пирофорными свойствами.
К газообразному азоту уран значительно более устойчив, чем к кислороду. При температурах ниже 400 о С реакция малозаметна, она ускоряется при 500-600 о С. Очень быстро идёт азотирование при 800 о С (что возможно связано с переходом урана в γ-фазу). При этом образуются нитриды: UN, U2N3
Уран образует насколько фторидов:
Взаимодействие со фтором компактного урана начинается уже при 25 о С, при этом образуется UF6. Скорость реакции определяется только скоростью подачи фтора. В технологии используют жидкие фторирующие агенты BrF3, ClF3 из-за трудности отвода большого количества тепла из системы газ (фтор) – твёрдое тело (уран).
С остальными галогенами уран также образует ряд соединений:
С галогеноводородами (HF, HCl, HBr, HI) уран взаимодействует лишь при повышенных температурах с образованием UF4, UCl3, UBr3 и смеси UI3+UI4 и выделением водорода.
Реакция с углеродом важна технологически из-за использования графита в качестве футеровочного материала печей. Плёнка карбидов (UC, U2C3, UC2), образующаяся на поверхности тигля при плавке металлического урана, устойчива до 1500-1650 о С и предохраняет металл от дальнейшего разъедания. Восстановительная плавка урана проводится при температурах ниже 1500 о С.
Уран также образует соединения с другими неметаллами:
Уран образует сплавы со всеми металлами за исключением щелочных, щёлочноземельных, тантала и вольфрама. Поэтому при кальцие- или магниетермическом восстановлении получают уран не загрязнённый металлом восстановителем.
Известно очень много интерметаллических соединений. Например:
Тот факт, что уран образует соединения со всеми неметаллами и интерметаллиды с большинством металлов затрудняют получение урана в чистом виде. Остро встаёт вопрос о конструкционных материалах аппаратов, т.к. U взаимодействует почти со всеми известными нам металлами, включая и его собственные соединения, например
С технологической точки зрения важно взаимодействие металлического урана с различными соединениями других металлов (особенно используемых в качестве футеровочных материалов).
Из оксидов с расплавленным ураном не лишь более термодинамически устойчивые окислы, у которых теплота образования по реакции металл – кислород выше, чем соответствующая теплота образования окислов урана. К ним относятся оксиды натрия, калия, магния, кальция, алюминия, тория. Некоторые из них нашли применение в качестве футеровочного материала (СаО, ThO2). Окислы металлов термодинамически менее устойчивые (SiO2, Fe2O3 и т.д.) восстанавливаются металлическим ураном и следовательно не могут быть использованы в качестве футеровочного материала. При взаимодействии урана с SiO2 при 700-800 о С происходит восстановление кремния с образованием силицидов и диоксида урана:
Сказанное выше относится и к взаимодействию металлического расплавленного урана с другими соединениями, в частности с галогенидами. Расплавы хлоридов и фторидов щелочных и щёлочноземельных металлов (NaCl, CaF2, CaCl2, MgF2 и т.д.) не взаимодействуют с металлическим ураном. Один из этих галогенидов, плавиковый шпат – CaF2, применяется в качестве футеровочного материала для печей восстановительной плавки урана. Устойчивость урана в контакте в галогенидами щелочных и щёлочноземельных металлов также обуславливает возможность его электролитического получения и рафинирования из расплавов соответствующих соединений.
Классификация способов получения урана
Прежде чем систематически рассмотреть способы получения металлического урана, следует выяснить, почему в данном случае неприменимы традиционные в металлургии способы.
Какие традиционные способы и восстановители нашли широкое применение в металлургии? H2, CO, C и электрический ток для электролиза водных растворов.
Термодинамический анализ реакции:
ΔG = ΔH – TΔS, ΔG 1406 K
Уран элемент. Свойства, добыча, применение и цена урана
Открытие планетарного масштаба. Так можно назвать обнаружение учеными Урана. Планета открыта в 1781-ом году.
Ее обнаружение стало поводом для наречения одного из элементов таблицы Менделеева. Уран металлический выделили из смоляной обманки в 1789-ом.
Шумиха вокруг новой планеты еще не улеглась, поэтому, идея о названии нового вещества лежала на поверхности.
В конце 18-го века еще не было понятия радиоактивности. Между тем, это основное свойство земного урана.
Ученые, работавшие с ним, облучались, сами того не зная. Кто был первопроходцем, и каковы другие свойства элемента, расскажем далее.
Свойства урана
Из раствора выпал бурый осадок. Этот окисел Клапрот восстановил льняным маслом, прокалил. Получился черный порошок.
Позже выяснилось, что это был не чистый уран, а его диоксид. Отдельно элемент получили лишь через 60 лет, в 1841-ом году. А еще через 55 Антуан Беккерель открыл явление радиоактивности.
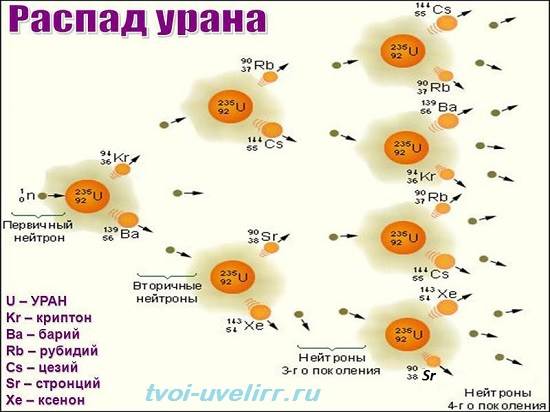
Радиоактивность урана обусловлена способностью ядра элемента захватывать нейтроны и дробиться. При этом, выделяется внушительная энергия.
Она обусловлена кинетическими данными излучения и осколков. Есть возможность обеспечить непрерывное деление ядер.
Цепная реакция запускается при обогащении природного урана его 235-ым изотопом. Его не то, чтобы добавляют в металл.
Наоборот, из руды убирают малорадиоактивный и неэффективный 238-ой нуклид, а так же, 234-ый.
Их смесь именуют обедненной, а оставшийся уран называют обогащенным. Именно такой нужен промышленникам. Но, об этом поговорим в отдельной главе.
Стало понятно, что новый элемент что-то излучает. Пока супруги Кюри исследовали, что именно, Мария получила дозу радиации, ставшей причиной развития у химика рака крови, от которого женщина умерла в 1934-ом году.
Бета-излучение способно разрушить не только человеческий организм, но и сам металл. Какой элемент образуется из урана? Ответ: — бревий.
Иначе его называют протактинием. Обнаружен в 1913-ом, как раз при изучении урана.
Последний превращается в бревий без сторонних воздействий и реактивов, лишь от бета-распада.
Внешне уран – химический элемент серебристо — белого цвета с металлическим блеском.
Так выглядят все актиноиды, к коим и относится 92-ое вещество. Начинается группа с 90-го номера, а заканчивается 103-им.
Стоя в начале списка, радиоактивный элемент уран, проявляет себя, как окислитель. Степени окисления могут быть 2-ой, 3-ей, 4-ой, 5-ой, 6-ой.
То есть, химически 92-ой металл активен. Если истереть уран в порошок, он самовоспламениться на воздухе.
В обычном виде вещество окислится при контакте с кислородом, покрывшись радужной пленкой.
Брось его в воду, — раствориться, как и чистый уран. Разъедают его и все кислоты. Из органических элемент вытесняет водород.
Урановые соли нестабильны, распадаются на свету, или в присутствии органики.
Индифферентен элемент, пожалуй, лишь к щелочам. С ними в реакцию металл не вступает.
Открытие урана – это обнаружение сверхтяжелого элемента. Его масса позволяет выделить металл, точнее, минералы с ним, из руды.
Достаточно раздробить ее и засыпать в воду. Урановые частицы осядут первыми. С этого начинается добыча металла. Подробности, в следующей главе.
Добыча урана
Получив тяжелый осадок, промышленники выщелачивают концентрат. Цель – перевести уран в раствор. Используют серную кислоту.
Исключение делают для смолки. Этот минерал в кислоте не растворим, поэтому, используют щелочи. Секрет трудностей в 4-валентном состоянии урана.
Достаточно нагреть руду с сульфидными минералами до 150-ти градусов и направить на нее кислородную струю. Это ведет к образованию в камнях кислоты, вымывающей уран.
Химический элемент и его применение связаны с чистыми формами металла. Дабы убрать примеси, используют сорбцию.
Ее проводят на ионообменных смолах. Подходит, так же, экстракция органическими растворителями.
Итогом станут оксиды 92-го элемента. Их нагревают до 800-от градусов и восстанавливают водородом.
Применение урана
92-ой металл – основное топливо ядерных реакторов. Обедненная смесь подходит для стационарных, а для силовых установок используют обогащенный элемент.
У самого 238-го урана велик период полураспада, он длится 4,5 миллиардов лет. Столь длительное разрушение приводит к малой энергоемкости.
Если рассматривать применение соединений урана, пригождаются его оксиды. Их используют в стекольной промышленности.
Оксиды выступают красителями. Можно получить стекла от бледно-желтых до темно-зеленых. В ультрафиолетовых лучах материал флуоресцирует.
В итоге, фон изделий безопасен, не превышает 30-ти микрон в час. Фото элементов урана, точнее, изделий с его участием, весьма красочны. Свечение стекол и посуды притягивает взоры.
Цена урана
За килограмм необогащенной окиси урана дают около 150-ти долларов. Пиковые значения наблюдались в 2007-ом.
Тогда стоимость достигала 300-от долларов за кило. Разработки урановых руд останутся рентабельными и при цене в 90-100 условных единиц.
Кто открыл элемент уран, не знал, каковы его запасы в земной коре. Теперь, они подсчитаны.
Крупные месторождения с рентабельной ценой добычи истощатся к 2030-му году.
Если не откроют новых залежей, или не найдут альтернативы металлу, его стоимость поползет вверх.
Химический элемент уран: свойства, характеристика, формула. Добыча и применение урана
Уран – химический элемент семейства актиноидов с атомным номером 92. Является важнейшим ядерным топливом. Его концентрация в земной коре составляет около 2 частей на миллион. К важным урановым минералам относятся окись урана (U3O8), уранинит (UO2), карнотит (уранил-ванадат калия), отенит (уранил-фосфат калия) и торбернит (водный фосфат меди и уранила). Эти и другие урановые руды являются источниками ядерного топлива и содержат во много раз больше энергии, чем все известные извлекаемые месторождения ископаемого топлива. 1 кг урана 92U дает столько же энергии, сколько 3 млн кг угля.
История открытия
Химический элемент уран – плотный, твердый металл серебристо-белого цвета. Он пластичный, ковкий и поддается полировке. В воздухе метал окисляется и в измельченном состоянии загорается. Относительно плохо проводит электричество. Электронная формула урана – 7s2 6d1 5f3.
Хотя элемент был обнаружен в 1789 г. немецким химиком Мартином Генрихом Клапротом, который назвал его в честь недавно открытой планеты Уран, сам металл был изолирован в 1841 г. французским химиком Эженом-Мельхиором Пелиго путем восстановления из тетрахлорида урана (UCl4) калием.
Радиоактивность
Открытие цепной реакции
Состояния окисления
Ядерное топливо
При воздействии медленных нейтронов деление атома урана происходит в относительно редком изотопе 235 U. Это единственный природный расщепляющийся материал, и он должен быть отделен от изотопа 238 U. Вместе с тем после поглощения и отрицательного бета-распада уран-238 превращается в синтетический элемент плутоний, который расщепляется под действием медленных нейтронов. Поэтому природный уран можно использовать в реакторах-преобразователях и размножителях, в которых деление поддерживается редким 235 U и одновременно с трансмутацией 238 U производится плутоний. Из широко распространенного в природе изотопа тория-232 может быть синтезирован делящийся 233 U для использования в качестве ядерного топлива. Уран также важен как первичный материал, из которого получают синтетические трансурановые элементы.
Другие применения урана
Соединения химического элемента ранее использовались в качестве красителей для керамики. Гексафторид (UF6) представляет собой твердое вещество с необычно высоким давлением паров (0,15 атм = 15 300 Па) при 25 °C. UF6 химически очень реактивный, но, несмотря на его коррозионную природу в парообразном состоянии, UF6 широко используется в газодиффузионных и газоцентрифужных методах получения обогащенного урана.
Металлоорганические соединения представляют собой интересную и важную группу соединений, в которых связи металл-углерод соединяют металл с органическими группами. Ураноцен является органоураническим соединением U(С8Н8)2, в котором атом урана зажат между двумя слоями органических колец, связанными с циклооктатетраеном C8H8. Его открытие в 1968 г. открыло новую область металлоорганической химии.
Обедненный природный уран применяется в качестве средства радиационной защиты, балласта, в бронебойных снарядах и танковой броне.
Переработка
Кристаллические формы
Характеристики урана обусловливают его реакцию с кислородом и азотом даже в нормальных условиях. При более высоких температурах он вступает в реакцию с широким спектром легирующих металлов, образуя интерметаллические соединения. Образование твердых растворов с другими металлами происходит редко из-за особых кристаллических структур, образованных атомами элемента. Между комнатной температурой и температурой плавления 1132 °C металлический уран существует в 3 кристаллических формах, известных как альфа (α), бета (β) и гамма (γ). Трансформация из α- в β-состояние происходит при 668 °C и от β до γ – при 775 °C. γ-уран имеет объемноцентрированную кубическую кристаллическую структуру, а β – тетрагональную. α-фаза состоит из слоев атомов в высокосимметричной орторомбической структуре. Эта анизотропная искаженная структура препятствует атомам легирующих металлов заменять атомы урана или занимать пространство между ними в кристаллической решетке. Обнаружено, что твердые растворы образуют только молибден и ниобий.
Земная кора содержит около 2 частей урана на миллион, что говорит о его широком распространении в природе. По оценкам, океаны содержат 4,5 × 10 9 т этого химического элемента. Уран является важной составляющей более чем 150 различных минералов и второстепенным компонентом еще 50. Первичные минералы, обнаруженные в магматических гидротермальных жилах и в пегматитах, включают уранинит и его разновидность настуран. В этих рудах элемент встречается в форме диоксида, который вследствие окисления может варьироваться от UO2 до UO2,67. Другой экономически значимой продукцией урановых рудников являются аутунит (гидратированный уранилфосфат кальция), тобернит (гидратированный уранилфосфат меди), коффинит (черный гидратированный силикат урана) и карнотит (гидратированный уранил-ванадат калия).
По оценкам, более 90 % известных недорогих запасов урана приходится на Австралию, Казахстан, Канаду, Россию, Южную Африку, Нигер, Намибию, Бразилию, КНР, Монголию и Узбекистан. Большие месторождения находятся в конгломератных скальных образованиях озера Эллиот, расположенного к северу от озера Гурон в Онтарио, Канада, и в южноафриканском золотом прииске Витватерсранде. Песчаные образования на плато Колорадо и в Вайомингском бассейне западной части США также содержатся значительные запасы урана.
Добыча
Урановые руды встречаются как в приповерхностных, так и глубоких (300–1200 м) отложениях. Под землей мощность пласта достигает 30 м. Как и в случае с рудами других металлов, добыча урана на поверхности производится крупным землеройным оборудованием, а разработка глубоких отложений – традиционными методами вертикальных и наклонных шахт. Мировое производство уранового концентрата в 2013 г. составило 70 тыс. т. Наиболее продуктивные урановые рудники расположены в Казахстане (32 % всей добычи), Канаде, Австралии, Нигере, Намибии, Узбекистане и России.
Урановые руды обычно включают лишь небольшое количество ураносодержащих минералов, и они не поддаются плавке прямыми пирометаллургическими методами. Вместо этого для извлечения и очистки урана должны использоваться гидрометаллургические процедуры. Повышение концентрации значительно снижает нагрузку на контуры обработки, но ни один из обычных способов обогащения, обычно используемых для переработки полезных ископаемых, например гравитационный, флотация, электростатический и даже ручная сортировка, неприменимы. За немногими исключениями эти методы приводят к значительной потере урана.
Обжиг
Гидрометаллургической обработке урановых руд часто предшествует высокотемпературная стадия кальцинирования. Обжиг обезвоживает глину, удаляет углеродистые материалы, окисляет соединения серы до безобидных сульфатов и окисляет любые другие восстановители, которые могут мешать последующей обработке.
Выщелачивание
Из обожженных руд уран извлекается как кислотными, так и щелочными водными растворами. Для успешного функционирования всех систем выщелачивания химический элемент должен либо первоначально присутствовать в более стабильной 6-валентной форме, либо окисляться до этого состояния в процессе обработки.
Перед дальнейшей обработкой растворы, образующиеся в результате кислотного или карбонатного выщелачивания, должны быть осветлены. Крупномасштабное разделение глин и других рудных шламов осуществляется за счет использования эффективных хлопьеобразующих агентов, в том числе полиакриламидов, гуаровой смолы и животного клея.
Экстракция
Сложные ионы [UO2(СО3)3] 4- и [UO2(SO4)3] 4- могут быть сорбированы из их соответствующих выщелачивающих растворов ионообменных смол. Эти специальные смолы, характеризующиеся кинетикой их сорбции и элюирования, размером частиц, стабильностью и гидравлическими свойствами, могут использоваться в различных технологиях обработки, например в неподвижном и подвижном слое, методом ионообменной смолы в пульпе корзинного и непрерывного типа. Обычно для элюирования сорбированного урана используют растворы хлорида натрия и аммиака или нитратов.
Уран можно выделить из кислых рудных щелоков путем экстракции растворителем. В промышленности используются алкилфосфорные кислоты, а также вторичные и третичные алкиламины. Как правило, экстракция растворителем предпочтительна по сравнению с ионообменными методами для кислотных фильтратов, содержащих более 1 г/л урана. Однако этот метод не применяется при карбонатном выщелачивании.
Затем уран очищают, растворяя в азотной кислоте с образованием уранилнитрата, экстрагируют, кристаллизуют и прокаливают с образованием трехокиси UO3. Восстановленный диоксид UO2 реагирует с фтористым водородом с образованием тетафторида UF4, из которого металлический уран восстанавливается магнием или кальцием при температуре 1300 °C.
Тетрафторид можно фторировать при температуре 350 °C до образования гексафторида UF6, используемого для отделения обогащенного урана-235 методом газовой диффузии, газового центрифугирования или жидкой термодиффузии.